
【题目】转鼓指数是反映烧结矿的机械强度的物理性能指标,其值越大,机械强度越好。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如下:
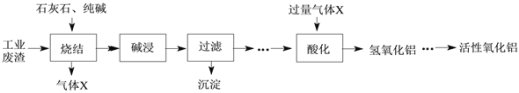
(1)烧结时往往需要加入MgO以提高烧结产物的转鼓指数,下图是转鼓指数与MgO含量的关系曲线。根据此图可知,最适宜的MgO含量是____%。
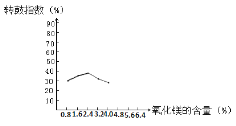
(2)烧结产物主要有NaAlO2、Ca2SiO4、NaFeO2及气体X。气体X是____。
(3)碱浸前需将烧结产物进行粉碎,其目的是____。碱浸过程中,NaFeO2可与水反应生成NaOH和一种含铁的化合物,该含铁的化合物是____。
(4)酸化时发生反应的离子方程式是____。
【答案】2.4 CO2 增大反应物接触面积,加快反应速率,提高烧结产物的浸出率 Fe(OH)3 AlO2- + CO2+ 2H2O= Al(OH)3↓+HCO3-
【解析】
(1)根据题干可知转鼓指数越大,机械强度越好,来确定最适宜的氧化镁含量。
(2)根据烧结产物主要有NaAlO2、Ca2SiO4、NaFeO2可知石灰石,纯碱与Al2O3、Fe2O3、SiO2发生反应确定气体产物。
(3)将烧结产物进行粉碎用来增大反应物的接触面积,加快反应速率并且提高烧结产物浸出率;碱浸过程中,NaFeO2与水反应生成NaOH和一种含铁的化合物,可以确定是弱酸强碱盐发生了水解。
(4)根据强酸制弱酸原理书写离子方程式,要注意通入了过量二氧化碳。
(1)转鼓指数是反映烧结矿的机械强度的物理性能指标,其值越大,机械强度越好,根据图像选择最高点,确定最适宜的氧化镁含量为2.4%;
正确答案:2.4。
(2)根据题给工艺流程和信息可知,烧结过程中Al2O3、Fe2O3、SiO2与碳酸钠、碳酸钙反应化学方程式为Al2O3+Na2CO3![]() 2NaAlO2+CO2↑,Fe2O3+Na2CO3
2NaAlO2+CO2↑,Fe2O3+Na2CO3![]() 2NaFeO2+CO2↑,SiO2+2CaCO3
2NaFeO2+CO2↑,SiO2+2CaCO3![]() Ca2SiO4+2CO2↑,因此气体X为二氧化碳;
Ca2SiO4+2CO2↑,因此气体X为二氧化碳;
正确答案:CO2。
(3)碱浸前需将烧结产物进行粉碎,其目的是增大反应物的接触面积,提高烧结产物浸出率,碱浸过程中,NaFeO2完全水解生成氢氧化铁沉淀和氢氧化钠,水解反应的离子方程式为FeO2-+2H2O=Fe(OH)3↓+OH-;
正确答案:Fe(OH)3。
(4)根据题给流程知,酸化过程为偏铝酸钠溶液中通入过量二氧化碳,生成沉淀为Al(OH)3,离子方程式AlO2- + CO2+ 2H2O= Al(OH)3↓+HCO3-;
正确答案:AlO2- + CO2+ 2H2O= Al(OH)3↓+HCO3-。


科目:高中化学 来源: 题型:
【题目】如右图所示,将SO2通入下列不同溶液中,实验现象与所得结论不正确的是
溶液 | 现象 | 结论 |
| |
A | 品红溶液 | 红色溶液褪色 | SO2有漂白性 | |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 | |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 | |
D | 滴有酚酞的NaOH溶液 | 红色溶液褪色 | SO2的水溶液呈酸性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1mol SiO2晶体中含有Si-O键的数目为0.2NA
B. 56g铁粉与高温水蒸气反应,生成H2数目为1.5NA
C. 标准状况下,22.4 LCl2溶于水,转移电子数为NA
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液能大量共存的一组离子是( )
A.Na+、Al3+、Cl-、OH-
B.H+、K+、SO42-、CO32-
C.K+、Ba2+、Cl-、NO3-
D.Na+、NH4+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物环丙叉环丙烷,由于其特殊的电导结构一直受到理论化学家的注意,其结构如图所示。有关它的说法中错误的是( )
![]()
A. 其二氯代物有4种 B. 它所有的原子均在同一平面上
C. 其分子式为C6H8 D. 它不可能是环丙烷的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法错误的是

A. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
B. 充电时,Mo(钼)箔接电源的负极
C. 充电时,Na+通过交换膜从左室移向右室
D. 外电路中通过0.2mol电子的电量时,负极质量变化为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
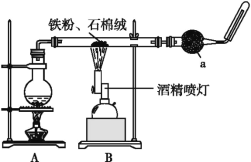
(1)已知该实验反应的反应方程式为:Fe+H2O![]() Fe3O4+H2(请配平)____。
Fe3O4+H2(请配平)____。
(2)仪器a的名称是________。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
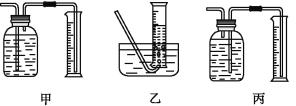
①该同学应该先点燃___(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6 g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.448 L,则铁粉的转化率为___。(![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____________ | Ⅲ.反应后的溶液中阳离子为_______ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现____色沉淀,迅速变为灰绿色,最终变为______色 | ①____________ ②Fe2++2OH—=Fe(OH)2↓ ③4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置进行实验:加热钠至熔化后,停止加热并通入氯气,钠剧烈燃烧并生成大量白烟。以下叙述错误的是
![]()
A. 钠着火燃烧产生苍白色火焰
B. 反应生成的大量白烟是氯化钠固体小颗粒
C. 棉球处发生的化学反应是: Cl2+2NaOH=NaCl+NaClO+H2O
D. 可在棉球右侧用湿润的淀粉碘化钾试纸判断氯气是否被碱液完全吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com