酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.回答下列问题:
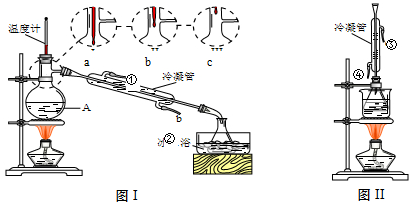
(1)米酒中乙醇含量可采用蒸馏法测定,装置如图Ⅰ所示.仪器A的名称是
;A中温度计的位置正确的是
(选填a、b或c);
(2)收集乙醇的锥形瓶需置于冰水浴中,其目的是
.欲收集无水乙醇,可加入足量的
(填物质名称)后再进行蒸馏.
(3)为测定某白酒样品的总酸量,取20.00mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010mol/L的NaOH标准溶液滴定至终点.判断终点的依据是
.若该白酒样品为优质级,则消耗NaOH溶液体积应不小于
mL.
(4)白酒中的总酯量可用返滴法测定.往上题滴定后的溶液(恰好至终点)中再加入20.00mL 0.100mol/L NaOH标准溶液,用图Ⅱ装置水浴加热半小时.冷却后用0.100mol/L的硫酸标准溶液滴定至终点.加热半小时的目的是
.已知最终消耗硫酸标准溶液7.70mL,该白酒样品中总酯量为
g/L.
(5)下列操作会使总酯量测定结果偏高的是
(选填编号)
a.加热时未使用水浴和冷凝管
b.选用了甲基橙为指示剂
c.滴定前滴定管内无气泡,滴定后产生气泡
d.滴定管未用硫酸标准溶液润洗
(6)图Ⅰ和图Ⅱ的装置中均用到了冷凝管,其进水口分别为
(选填编号)
a.①③b.②④c.②③d.①④




 全能测控一本好卷系列答案
全能测控一本好卷系列答案