
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
分析 ①碳酸钙煅烧生成氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙;
②氯化铝溶液与氨气反应生成氢氧化铝,而不是偏铝酸钠;
③FeS2和氧气反应生成二氧化硫;
④氨气催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸.
解答 解:①碳酸钙煅烧生成氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙,可以实现各步转化,故正确;
②氯化铝溶液与氨气反应生成氢氧化铝,而不是偏铝酸钠,故错误;
③FeS2和氧气反应生成二氧化硫,不能直接生成三氧化硫,故错误;
④氨气催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,可以实现各步转化,故正确;
故选B.
点评 本题考查化合物的性质,题目难度不大,熟练掌握物质的性质是解决此类问题的关键,正确运用物质分类及反应规律则是解决此类问题的有效方法.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质C和D的浓度相等 | |
| B. | 混合气体的平均相对分子质量不再变化 | |
| C. | A的物质的量浓度不再变化 | |
| D. | 物质B,C,D的物质的量之比为2:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
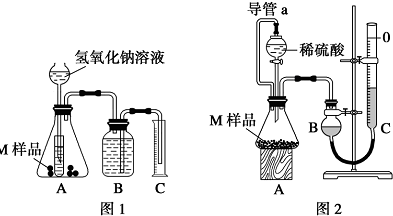
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:学习小组的同学设计了滴定的方法测定x值.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
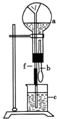 在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/L NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | CCl4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com