
| A、原子半径大小顺序:r(Z)>r(W)>r(X>)r(Y) |
| B、Y分别与Z、W形成的化合物中化学键类型相同 |
| C、X的最高价氧化物对应水化物的酸性比W的弱 |
| D、Y的气态简单氢化物的热稳定性比W的强 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| B、利用丁达尔效应可以区别溶液与胶体 |
| C、质子数相同的粒子不一定是同一种元素 |
| D、1 mol CH4燃烧所放出的热量是CH4的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 非金属性:Cl>S | 酸性:HClO>H2SO3 |
| B | SO2有氧化性 | SO2能使酸性KMnO4溶液褪色 |
| C | NH3.H2O为一元弱碱 | 含有NH4+的水溶液均显弱碱性 |
| D | 锌的金属性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧燃料电池中O2通入负极 |
| B、铅蓄电池在放电时,其负极的电极反应为:Pb-2e═Pb2+ |
| C、碱性锌锰电池在工作时,电解质中的OH-移向正极 |
| D、在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
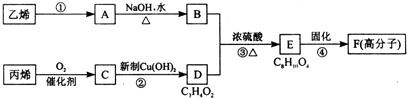
| A、反应④的反应类型是缩聚反应 |
| B、物质A是卤代烃 |
| C、物质B催化氧化后可以得到乙醛 |
| D、1 mol物质D最多可以消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、超临界二氧化碳与CO2的物理性质不同,化学性质相同 |
| B、超临界二氧化碳可能是一种原子晶体 |
| C、用超临界二氧化碳溶解萃取物质,符合绿色化学的思想 |
| D、用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小 |
| B、常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
| C、NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-) |
| D、0.1mol/L的NaHA溶液,其pH=4时:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com