
| A、①② | B、③④ | C、②③ | D、①④ |


科目:高中化学 来源: 题型:
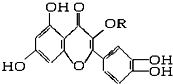
| A、可与溴水反应,且1 mol该物质与足量溴水反应耗6 mol Br2 |
| B、可与NaOH溶液反应,1 mol该物质可与4 mol NaOH反应 |
| C、一定条件下1 mol该物质可与H2加成,耗H2最大量为7 mol |
| D、维生素P遇FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管尖嘴部分有气泡,滴定后消失 |
| B、滴定终点读数时俯视读数 |
| C、用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| D、锥形瓶水洗后未干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的硝酸跟pH=11的氢氧化钾溶液 |
| B、pH=3的盐酸跟pH=11的氨水 |
| C、0.1mol/LCH3COOH与0.1mol/LNaOH溶液 |
| D、pH=3的醋酸跟pH=11的氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的硫化钾溶液中:c(OH-)>c(HS-)+2c(H2S) |
| B、常温下,pH=7的CH3COOH与CH3COONa的混合液中:c(CHC3OO-)<c(Na+) |
| C、0.1mol?L-1的NH4Cl溶液中:c(NH4+)>c(H+)>c(Cl-)>c(OH-) |
| D、pH=3的一元酸和pH=11的一元强碱等体积混合:c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
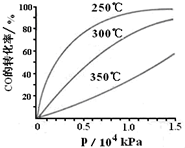 科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知:
科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知:| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
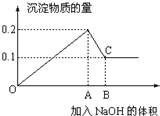 在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则:
在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则:查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
| B | 将Cl2通入NaBr溶液中 | 比较氯离子与溴离子的氧化性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com