
下列实验的措施中不正确的是
A.容量瓶使用前必须先检查瓶塞是否漏水
B.用棕色的滴瓶盛放新制的浓溴水
C.刚制备完醛酚树脂的试管中的残污可用酒精洗掉,但将污迹加热后却不能用酒精洗掉
D.用12mol/L盐酸可洗去制氯气后瓶中的黑色污迹
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:阅读理解
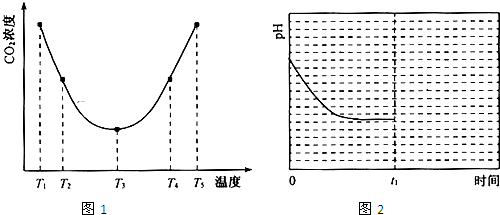
查看答案和解析>>
科目:高中化学 来源: 题型:
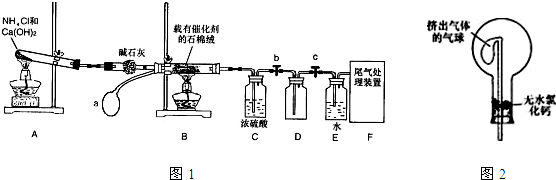
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验 序号 |
温度℃ | 初始n(CCl4) (mol) |
初始n(H2) (mol) |
平衡时n(CHCl3) (mol) |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
查看答案和解析>>
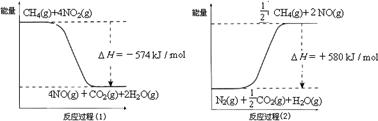
科目:高中化学 来源: 题型:
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
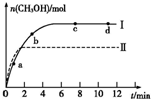
科目:高中化学 来源: 题型:阅读理解
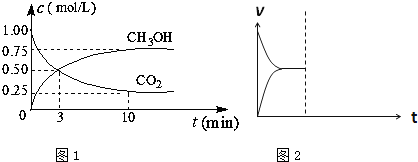
| 催化剂 |
| 温度/k CO2转化率% |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com