
科目:高中化学 来源:不详 题型:单选题
| A.常温下反应2M2+ + Z2 ="=" 2M3+ + 2Z-可以自发进行 |
| B.Z元素在反应①中被氧化,在③中被还原 |
| C.氧化性强弱顺序为: XO4- < Z2 < R2 < M3+ |
| D.还原性强弱顺序为: X2+ < Z- < R- < M2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
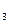 )
)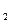 、Mg(NO
、Mg(NO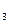 )
)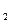 和AgNO
和AgNO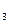 的溶液中加入适量锌粉,首先置换出来的是( )
的溶液中加入适量锌粉,首先置换出来的是( )| A.Mg | B.Cu | C.Ag | D.H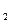 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| ||
| A.MnO2、FeCl3、Cl2、CuCl2 | B.Cl2、FeCl3、MnO2、CuCl2 |
| C.MnO2、Cl2、FeCl3、CuCl2 | D.CuCl2、FeCl3、Cl2、MnO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应中,硫元素部分被氧化,氮元素部分被还原 |
| B.反应中每产生1molN2必同时产生2molSO2 |
| C.反应中每转移1mol电子就会生成0.5molSO2 |
| D.当(NH4)2SO4的计量数为4时,产生NH3和SO2的物质的量之比为1:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.O2和H2O是还原产物 | B.该反应能说明O3氧化性大于I2 |
C.氧化产物与还原物的物质的量之比是1:1 | D.配平后的化学方程式为:2O3+2I—+4H+I2+2O2+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有① | B.只有②③ | C.只有①④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
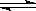 Cr2O72-(aq)+H2O。若要使溶液的橙色加深,下列可采用的方法是:
Cr2O72-(aq)+H2O。若要使溶液的橙色加深,下列可采用的方法是:| A.加入适量稀盐酸 | B.加入适量稀硝酸 | C.加入适量烧碱固体 | D.加水稀释 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com