
���� K2CO3��K2SO4��BaCl2��Ӧ����ʽ�ֱ�ΪK2CO3+BaCl2�TBaCO3��+2KCl��K2SO4+BaCl2�TBaSO4��+2KCl
������BaSO4������ϡ���ᣬ��BaCO3����ϡ���ᣬ����2.33g������ϡ�����������BaSO4��n��BaSO4��=$\frac{2.33g}{233g/mol}$=0.01mol��n��BaCO3��=$\frac{6.27g-2.33g}{197g/mol}$=0.02mol��
��1������Cԭ���غ��n��K2CO3��=n��BaCO3��=0.02mol������m=nM����̼���������
��2����Ӧ����Һ������ΪKCl������Sԭ���غ��n��K2SO4��=n��BaSO4��=0.01mol������Kԭ���غ����n��KCl��=2[n��K2CO3��+n��K2SO4��]=2����0.02mol+0.01mol��=0.06mol��������=0.06mol��74.5g/mol=4.47g��
��Һ������=m��K2CO3��+m��K2SO4��+m��H2O��+m��BaCl2��Һ��-m��BaSO4��-m��BaCO3����
��Һ��������=$\frac{���ʵ�����}{��Һ������}��100%$��
��� �⣺K2CO3��K2SO4��BaCl2��Ӧ����ʽ�ֱ�ΪK2CO3+BaCl2�TBaCO3��+2KCl��K2SO4+BaCl2�TBaSO4��+2KCl
������BaSO4������ϡ���ᣬ��BaCO3����ϡ���ᣬ����2.33g������ϡ�����������BaSO4��n��BaSO4��=$\frac{2.33g}{233g/mol}$=0.01mol��n��BaCO3��=$\frac{6.27g-2.33g}{197g/mol}$=0.02mol��
��1������Cԭ���غ��n��K2CO3��=n��BaCO3��=0.02mol����m��K2CO3��=nM=0.02mol��138g/mol=2.76g��
�𣺹�����̼��ص�������2.76g��
��2����Ӧ����Һ������ΪKCl������Sԭ���غ��n��K2SO4��=n��BaSO4��=0.01mol��m��K2SO4��=0.01mol��174g/mol=1.74g������Kԭ���غ����n��KCl��=2[n��K2CO3��+n��K2SO4��]=2����0.02mol+0.01mol��=0.06mol��������=0.06mol��74.5g/mol=4.47g��
��Һ������=m��K2CO3��+m��K2SO4��+m��H2O��+m��BaCl2��Һ��-m��BaSO4��-m��BaCO3��=2.76g+1.74g+85g+200g-6.27g=283.23g��
��Һ��������=$\frac{���ʵ�����}{��Һ������}��100%$=$\frac{4.47g}{283.23g}$��100%=1.6%��
�𣺷�Ӧ���ձ���������Һ��������������Ϊ1.6%��
���� ���⿼�黯ѧ����ʽ�йؼ��㣬Ϊ��Ƶ���㣬���ؿ���ѧ���������㼰֪ʶ���������������ȷ����������֮��Ĺ�ϵ�ǽⱾ��ؼ���ע��ԭ���غ��������ã�ע�⣨2������Һ��������������������Ϊ�״��㣮


 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
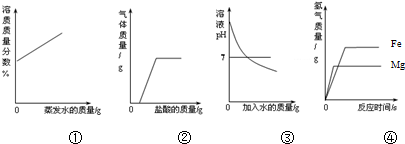
| A�� | ���ں��µ������£����������Ȼ��Ʊ�����Һ����������ˮ�� | |
| B�� | ����¶���ڿ����в��ֱ��ʵ�����������Һ�м���ϡ���� | |
| C�� | ��������������Һ�в��ϼ�ˮϡ�� | |
| D�� | ����ͬ�������ҹ�����þ�ۺ����ۣ��ֱ�������������������ͬ��ϡ���ᷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
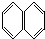 ����������巢��ȡ����Ӧ�����ƶ����ɵ�һ��ȡ�����������м��֣�������
����������巢��ȡ����Ӧ�����ƶ����ɵ�һ��ȡ�����������м��֣�������| A�� | 2 | B�� | 3 | C�� | 4 | D�� | 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 4 3 2 2 6 | B�� | 0 2 1 0 1 2 | ||
| C�� | 2 0 1 2 0 2 | D�� | 2 2 2 2 1 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ����ʵ | ���� | |
| A | Cl2��ˮ��Һ�ܵ��� | Cl2�ǵ���� |
| B | SO2ͨ�����ᱵ��Һ���ְ�ɫ���� | BaSO3������ǿ�� |
| C | ���������Ҵ���Ӧ��������ˮ��Ӧ���� | �Ҵ������е��ǻ���ԭ�Ӳ���ˮ�����е���ԭ�ӻ��� |
| D | ������е���ʯ����Һ��SO2ˮ��Һ����ɫ��ȥ | SO2����Ư���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
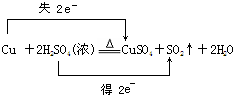 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͭ | B�� | ������̼ | C�� | ���ʯ | D�� | �Ȼ��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com