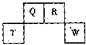
��2012?������һģ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺
��1��T�����ӽṹʾ��ͼΪ
��
��2��Ԫ�صķǽ�����Ϊ��ԭ�ӵĵõ�����������Q
����
����
W���ǿ�ڡ������ڡ�����
��3��W�ĵ�����������������ˮ����Ũ��Һ�����ܷ�����Ӧ�������������ʣ�����һ�������壬��Ӧ�Ļ�ѧ����ʽΪ
��
��4��ԭ��������R��1��Ԫ�ص�һ���⻯���ֽܷ�Ϊ������һ���⻯��˷ֽⷴӦ�Ļ�ѧ����ʽ��
��
��5��R�ж�����������м���Է���������С����һ�������£�2L�ļ�������0.5L���������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û����������������ɵ�R�ĺ������εĻ�ѧʽ��
NaNO2
NaNO2
I���ס���Ԫ�صĵ��ʺͻ�����Ӧ�ù㷺��
��1����Ԫ�ص�ԭ�Ӻ�������Ų�ʽ��
1s22s22p63s23p3
1s22s22p63s23p3
��
��2��������뽹̿��ʯӢɰ��ϣ��ڵ�¯�м��ȵ�1500�����ɰ��ף���ӦΪ��
2Ca
3��PO
4��
2+6SiO
2��6CaSiO
3+P
4O
10 10C+P
4O
10��P
4+10CO
ÿ����1mol P
4ʱ������
20
20
mol���ӷ���ת�ƣ�
II��ϡ��Ԫ���DZ����ս����Դ���ҹ����̲�����������λ��
��1���棨Ce���ǵؿ��к�����ߵ�ϡ��Ԫ�أ��ڼ���������CeCl
3����ˮ�⣬��ˮCeCl
3���ü���CeCl
3?6H
2O��NH
4Cl��������ķ������Ʊ�������NH
4Cl��������
�ֽ��HCl���壬����CeCl3��ˮ��
�ֽ��HCl���壬����CeCl3��ˮ��
��
��2����ijǿ���Ի��ϡ����Һ�м���H
2O
2������pH��3��Ce
3+ͨ�����з�Ӧ�γ�Ce��OH��
4�������Է��룮��ɷ�Ӧ�����ӷ���ʽ��
2
2
Ce
3++
1
1
H
2O
2+
6
6
H
2O��
2
2
Ce��OH��
4��+
6H+
6H+
����Һ�У���ӦA+2B?C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc��A��=0.100mol/L��c��B��=0.200mol/L��c��C��=0mol/L��
��Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ��
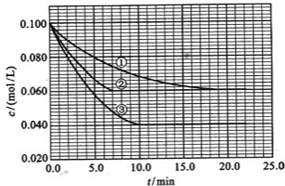
��ش��������⣺
��3����ٱȽϣ��ں͢۷ֱ���ı�һ�ַ�Ӧ���������ı���������жϵ������ǣ���
�Ӵ���
�Ӵ���
��
�ﵽƽ���ʱ�����̣�ƽ��ʱA��Ũ��δ��
�ﵽƽ���ʱ�����̣�ƽ��ʱA��Ũ��δ��
��
��
�¶�����
�¶�����
��
�ﵽƽ���ʱ�����̣�ƽ��ʱA��Ũ�ȼ�С
�ﵽƽ���ʱ�����̣�ƽ��ʱA��Ũ�ȼ�С
��
��4��ʵ���ƽ��ʱB��ת����Ϊ
40%
40%
��ʵ���ƽ��ʱC��Ũ��Ϊ
0.06mol/L
0.06mol/L
��
��5���÷�Ӧ��
����
����
�ȷ�Ӧ���ж���������
�¶����ߣ�ƽ��������Ӧ�����ƶ�
�¶����ߣ�ƽ��������Ӧ�����ƶ�
��
��6���÷�Ӧ���е�4.0minʱ��ƽ����Ӧ�ٶ��ʣ�
ʵ��ڣ�V
B=
0.014mol��L?min��-1
0.014mol��L?min��-1
��







 �ķ���ʽΪ
�ķ���ʽΪ

 �Լ���Ҫ�����Լ��ɺϳ�
�Լ���Ҫ�����Լ��ɺϳ� ��д����һ���ϳɷ�Ӧ�Ļ�ѧ����ʽ
��д����һ���ϳɷ�Ӧ�Ļ�ѧ����ʽ

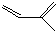 ��һ��ͬ���칹��A������һ�ȴ��������֣���Br2��1��1�ӳɲ���ֻ��һ�֣�������˳���������칹������A�Ľṹ��ʽΪ
��һ��ͬ���칹��A������һ�ȴ��������֣���Br2��1��1�ӳɲ���ֻ��һ�֣�������˳���������칹������A�Ľṹ��ʽΪ

 ����ʳƷ���Ӽ�������ԭ�ϣ�����ζ�����ȩ����Ũ����
����ʳƷ���Ӽ�������ԭ�ϣ�����ζ�����ȩ����Ũ����


 ����һ��ҽҩ�м��壮
����һ��ҽҩ�м��壮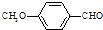 ���ϳ�D���÷�Ӧ����ͼ��ʾ���£��뽫����һ���ķ�Ӧ����д�ڼ����·����Լ���ԭ��д�ڼ����Ϸ����м����������ͼ�еķ����ڣ���д������ȩ��������Һ��Ӧ�Ļ�ѧ����ʽ��
���ϳ�D���÷�Ӧ����ͼ��ʾ���£��뽫����һ���ķ�Ӧ����д�ڼ����·����Լ���ԭ��д�ڼ����Ϸ����м����������ͼ�еķ����ڣ���д������ȩ��������Һ��Ӧ�Ļ�ѧ����ʽ��




 ��һ��ͬ���칹��A������һ�ȴ��������֣�������λ�õ�H������Br2��1��1�ӳɲ���ֻ��һ�֣���ṹ�Գƣ�
��һ��ͬ���칹��A������һ�ȴ��������֣�������λ�õ�H������Br2��1��1�ӳɲ���ֻ��һ�֣���ṹ�Գƣ� ��-OH��CHO�������к�7��λ�õ�Hԭ�ӣ�
��-OH��CHO�������к�7��λ�õ�Hԭ�ӣ�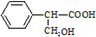 ��CΪ
��CΪ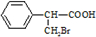 ��
��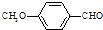 �ϳ�
�ϳ� ���ȷ���-CHO������Ӧ����-COOH������״������û���Ӧ������ȩ��������Һ��Ӧ��������李�����������ˮ��
���ȷ���-CHO������Ӧ����-COOH������״������û���Ӧ������ȩ��������Һ��Ӧ��������李�����������ˮ�� �ķ���ʽΪC10H16���ʴ�Ϊ��C10H16��
�ķ���ʽΪC10H16���ʴ�Ϊ��C10H16�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� �ϳ�
�ϳ� ����һ�����������1��4�ӳɣ��÷�ӦΪ
����һ�����������1��4�ӳɣ��÷�ӦΪ ��
�� ��
�� ��һ��ͬ���칹��A������һ�ȴ��������֣�������λ�õ�H������Br2��1��1�ӳɲ���ֻ��һ�֣���ṹ�Գƣ�A�Ľṹ��ʽΪ
��һ��ͬ���칹��A������һ�ȴ��������֣�������λ�õ�H������Br2��1��1�ӳɲ���ֻ��һ�֣���ṹ�Գƣ�A�Ľṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��-CHO��-OH������Ϊ���ǻ���ȩ���������к�7��λ�õ�Hԭ�ӣ���˴Ź���������7�ַ壬�ʴ�Ϊ��ȩ�������ǻ���7��
��-CHO��-OH������Ϊ���ǻ���ȩ���������к�7��λ�õ�Hԭ�ӣ���˴Ź���������7�ַ壬�ʴ�Ϊ��ȩ�������ǻ���7�� ��CΪ
��CΪ �����C��������ȡ����Ӧ���ʴ�Ϊ��ȡ����Ӧ��
�����C��������ȡ����Ӧ���ʴ�Ϊ��ȡ����Ӧ�� ��
�� ��
��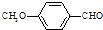 �ϳ�
�ϳ� ���ȷ���-CHO������Ӧ����-COOH������״������û���Ӧ������Ϊ
���ȷ���-CHO������Ӧ����-COOH������״������û���Ӧ������Ϊ ������ȩ��������Һ��Ӧ��������李�����������ˮ���÷�ӦΪ
������ȩ��������Һ��Ӧ��������李�����������ˮ���÷�ӦΪ ��
�� ��
�� ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
 ��2012?������һģ����NaCl��Һ����һ�����������������ϣ�һ��ʱ�����Һ�θ��ǵ�Բ����������a���ѱ���ʴ���䰵����Һ�������γ���ɫ�����b������ͼ��ʾ�����¸��������Ҫԭ����Һ��֮�����������ȱ�Ե�٣�����˵����ȷ���ǣ�������
��2012?������һģ����NaCl��Һ����һ�����������������ϣ�һ��ʱ�����Һ�θ��ǵ�Բ����������a���ѱ���ʴ���䰵����Һ�������γ���ɫ�����b������ͼ��ʾ�����¸��������Ҫԭ����Һ��֮�����������ȱ�Ե�٣�����˵����ȷ���ǣ������� ��2012?������һģ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺
��2012?������һģ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺


 ��2012?������һģ����a mol��Na2O2��bmol NaHCO3�����Ϻ����ܱ������м��ȵ�250�棬�����ַ�Ӧ������NaHCO3�ֽ������CO2��Na2O2��Ӧ���H2O����Na2O2��Ӧ��
��2012?������һģ����a mol��Na2O2��bmol NaHCO3�����Ϻ����ܱ������м��ȵ�250�棬�����ַ�Ӧ������NaHCO3�ֽ������CO2��Na2O2��Ӧ���H2O����Na2O2��Ӧ��