

 ��
��| �� |
| �� |
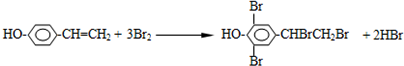





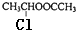 ��
��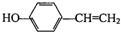 ��
��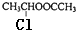 ��
�� ��
��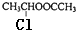 ��������������ԭ�ӣ������ܷ���ˮ�ⷴӦ����ȡ����Ӧ����
��������������ԭ�ӣ������ܷ���ˮ�ⷴӦ����ȡ����Ӧ����| �� |
| �� |
 ��F����ˮ�����ӳɷ�Ӧ�������䷴Ӧ����ʽΪ��
��F����ˮ�����ӳɷ�Ӧ�������䷴Ӧ����ʽΪ�� ��
�� ��
�� ��
�� ��
�� ��ͬ���칹�壬���б�����ȩ��-CHO��������һ��֧��Ϊ-CH2CHO��ֻ��1�ֽṹ������2��֧������ֱ�Ϊ-CH3��-CHO��2��֧�����ڡ��䡢������λ�ù�ϵ����3�ֽṹ���ʷ��������Ļ�����G�Ľṹ��1+3=4�֣�����һ��Ϊ
��ͬ���칹�壬���б�����ȩ��-CHO��������һ��֧��Ϊ-CH2CHO��ֻ��1�ֽṹ������2��֧������ֱ�Ϊ-CH3��-CHO��2��֧�����ڡ��䡢������λ�ù�ϵ����3�ֽṹ���ʷ��������Ļ�����G�Ľṹ��1+3=4�֣�����һ��Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 4C��l��+2D��g����ƽ��ʱ���n��C��=1.6mol������˵����ȷ���ǣ�������
4C��l��+2D��g����ƽ��ʱ���n��C��=1.6mol������˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2011?������ģ�⣩�ס��ҡ����������ɶ�����Ԫ����ɵ����ʣ���Ӧ���£���+�ҡ���+��
��2011?������ģ�⣩�ס��ҡ����������ɶ�����Ԫ����ɵ����ʣ���Ӧ���£���+�ҡ���+��| 2 | 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� |
| ���¸�ѹ |
| ���� |
| ���¸�ѹ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com