
| A. | 电子云表示电子在核外单位体积的空间出现的机会多少 | |
| B. | 同一原子处于激发态时的能量一定高于基态时的能量 | |
| C. | 各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7 | |
| D. | 1个原子轨道里最多只能容纳2个电子,且自旋方向相同 |
分析 A.电子云是用小黑点疏密来表示空间各电子出现概率大小的一种图形;
B.基态原子吸收能量变为激发态原子;
C.各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7;
D.根据泡利原理:1个原子轨道里最多只能容纳2个电子,且自旋方向相反.
解答 解:A.核外电子云表示电子在核外单位体积的空间出现的机会多少,是概率分布图,故A正确;
B.基态原子吸收能量变为激发态原子,所以激发态原子能量大于基态原子能量,故B正确;
C.根据电子云的空间形状可知,各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7,故C正确;
D.根据泡利原理:1个原子轨道里最多只能容纳2个电子,且自旋方向相反,故D错误.
故选D.
点评 本题考查原子核外电子的排布,为高频考点,侧重于学生的分析能力的考查,注意把握电子的排布规律,难度不大.


科目:高中化学 来源: 题型:解答题
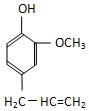 某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如图所示,请回答:
某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如图所示,请回答: 中的一种.
中的一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和NCl3两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| B. | CO2和SiO2的熔沸点和硬度差异很大,是由于它们所含的化学键类型不同 | |
| C. | 某些金属与非金属原子间能形成共价键 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高,是因为分子间作用力越来越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
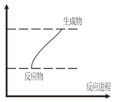
 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与CO2的反应 | B. | 铝片与稀盐酸的反应 | ||
| C. | Ba(OH)2•8H2O和NH4Cl的反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
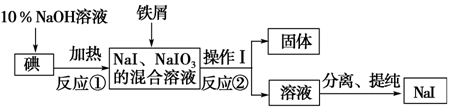
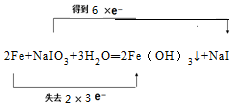 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
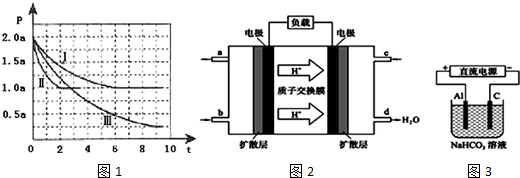
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
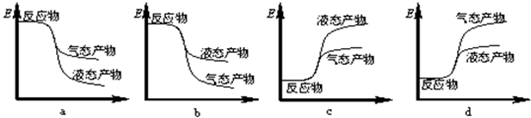
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
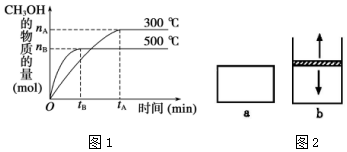 一定条件下,在体积为 3L 的密闭容器中反应 CO(g)+2H2(g)?CH3OH(g)△H=akJ•mol-1,△S=b J•mol-1•K-1(a、b 均为正数),达到化学平衡状态.
一定条件下,在体积为 3L 的密闭容器中反应 CO(g)+2H2(g)?CH3OH(g)△H=akJ•mol-1,△S=b J•mol-1•K-1(a、b 均为正数),达到化学平衡状态.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com