
【题目】Q、R、X、Y、Z为短周期主族元素,且原子序数依次递增。Q的低价氧化物与R单质分子的电子总数相等,X与Q同族,Y和Z的离子与Ar原子的电子结构相同。
(1)Q的最高价氧化物中Q的杂化类型为___,分子中含有___个σ键,___个π键。
(2)X的氢化物分子的立体构型是___,属于__分子(填“极性”或“非极性”);它与R形成的化合物可作为一种重要的陶瓷材料,其化学式是___。
(3)Q分别与Y、Z形成的共价化合物的化学式是___和___;Q与Y形成的分子的电子式是__,属于___分子(填“极性”或“非极性”)。
【答案】sp 2 2 正四面体 非极性 Si3N4 CS2 CCl4 ![]() 非极性
非极性
【解析】
Q、R、X、Y、Z为短周期主族元素,且原子序数依次递增。Q的低价氧化物与R单质分子的电子总数相等,满足条件为CO与N2,则Q为C,R为N;X与Q同族,则X为Si;Y和Z的离子与Ar原子的电子结构相同,则Y为S,Z为Cl。
(1) CO2含有2个σ键,2个π键,孤电子对为0,杂化类型为sp,故答案为:sp;2;2;
(2)Si的氢化物为SiH4,根据CH4的空间构型可知SiH4的空间构型为正四面体;SiH4分子中正负电荷重心重合,属于非极性分子;Si最外层有4个电子,N最外层有5个电子,它们形成化合物时,Si为+4价,N为-3价,其化学式为Si3N4,故答案为:正四面体;非极性;Si3N4;
(3) C与S可形成CS2,根据CO2的结构可写出CS2的电子式为:![]() ,并知其为非极性分子;C与Cl形成CCl4分子,故答案为:CS2;CCl4;
,并知其为非极性分子;C与Cl形成CCl4分子,故答案为:CS2;CCl4;![]() ;非极性。
;非极性。


科目:高中化学 来源: 题型:
【题目】某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。下列说法不正确的是

A. 步骤②中分离操作的名称是过滤,Mg(OH)2可以作阻燃剂是因为它分解需要吸收大量的热
B. 步骤①中的反应式:3Fe(OH)3 +S2O42-+2OH- =3Fe(OH)2 +2SO42-+4H2O
C. 步骤①中保险粉是作还原剂
D. 从步骤② 中可知OH- 和EDTA共存时,Fe2+更易和EDTA结合,生成可溶性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是( )
A.BF3与PCl3为三角锥形B.SO3与CO32-为平面三角形
C.SO2键角大于120oD.BF3是三角锥形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟气与水反应的化学方程式_______________________________________
铁与水蒸气反应的化学方程式______________________________________
n(FeBr2): n(Cl2)=1:1反应的离子方程式_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是
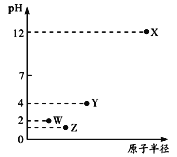
A. 简单离子半径: X>Y>Z>W
B. W的单质在常温下是黄绿色气体
C. 气态氢化物的稳定性: Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼[(CH3)2N—NH2]与 N2O4 是常用的火箭推进剂,火箭发射时常出现红棕色气体,发生的化学反应如下:
① (CH3)2N—NH2(1)+2N2O4(1) = 2CO2(g)+3N2(g)+4H2O(g) △H1<0
②N2O4(1) ![]() 2NO2(g) △H2>0
2NO2(g) △H2>0
下列说法不正确的是 ( )
A.反应①中,N2O4 为氧化剂
B.反应①中,生成1mo1CO2 时,转移16mo1e-
C.由反应②推断:加压、降温是获得液态 N2O4的条件
D.温度升高,反应①的化学反应速率减小、反应②的化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
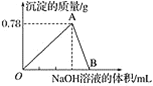
(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com