
(16分)氯气在298 K、100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的化学方程式为________________________________________________;
(2)估算该反应的平衡常数________________________________(列式计算);
(3)在上述平衡体系中加入少量NaCl固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”、“减小”或“不变”),平衡将向________移动。
(5)已知:H2CO3  HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- CO32- + H+ Ka2(H2CO3) = 5.61×10-11
CO32- + H+ Ka2(H2CO3) = 5.61×10-11
HClO H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
(6)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是 。

A.MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B.Mg与X2的反应是放热反应
C.化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
D.MgF2(s)+Br2(l)===MgBr2(s)+F2(g) ΔH=+600 kJ·mol- 1
依上图数据写出 MgBr2(s)与 Cl2(g)反应的热化学方程式 。
(1)Cl2+H2O HCl +HClO (2)0.015mol/L (3)逆反应方向
HCl +HClO (2)0.015mol/L (3)逆反应方向
(4)增大 正反应方向 (5) Cl2+2CO32-+H2O=Cl-+ClO-+2HCO3-
(6)A B D;Cl2(g)+MgBr2(s)=MgCl(s)+Br2(l) △H=-117.3KJ/mol
【解析】
试题分析:(1)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O H++Cl-+HClO;
H++Cl-+HClO;
(2)在1L水中可溶解0.09mol氯气,近似氯气浓度为0.09mol/L,则
Cl2+H2O HCl+HClO
HCl+HClO
起始浓度:0.09 0 0
转化浓度:0.03 0.03 0.03
平衡浓度:0.06 0.03 0.03
则K=(0.03×0.03)÷0.06=0.015mol/L;
(3)在上述平衡体系中加入少量NaCl固体,增大溶液中的氯离子离子,平衡向逆反应方向进行;
(4)在上述平衡中加压,平衡向气体体积减小的反应方向进行,即平衡向正反应方向移动,氯气的溶解量会增加;
(5)根据电离平衡常数可知碳酸的酸性强于次氯酸,但次氯酸的酸性强于碳酸氢根离子的,则将少量的氯气通入到过量的碳酸钠溶液中生成氯化钠、次氯酸钠和碳酸氢钠,离子方程式为Cl2+2CO32-+H2O=Cl-+ClO-+2HCO3-。
(6)A、相同类型的离子晶体中,离子键越大,则离子间作用力越强,物质含有的能量越低,所以MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力,故正确;B、根据图象知,反应物的能量大于生成物能量,所以Mg与F2的反应是放热反应,故正确;C、能量越小的物质越稳定,所以化合物的热稳定性顺序为MgI2<MgBr2<MgCl2<MgF2,故错误;D、⑤Mg(s)+F2(l)=MgF2(s)△H-1124kJ/mol,Mg(s)+Br2(l)MgBr2(s)△H-524kJ/mol,将第二个方程式与第一方程式相减得MgF2(s)+Br2(L)MgBr2(s)+F2(g);△H+600kJ?mol-1,故正确;答案为ABD。Mg(s)+Cl2(l)=MgCl2(s)△H=-641kJ/mol,Mg(s)+Br2(l)=MgBr2(s)△H=-524kJ/mol,将第一个方程式减去第二方程式得MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l)△H=-117KJ?mol-1。
考点:考查平衡常数计算与应用、外界条件对平衡状态的影响;物质结构与性质以及盖斯定律的应用等


科目:高中化学 来源:2015届四川省绵阳市高三“一诊”模拟考试理综化学试卷(解析版) 题型:实验题
(14分)某合成氨厂利用附近化工厂副产品CaSO4设计了以下制备(NH4)2SO4的工艺流程:
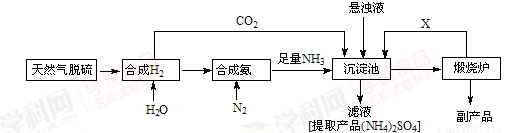
请回答以下问题:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)工业上在500℃左右使用铁触媒作为催化剂合成NH3,
①铁触媒中含有Fe3+,,则Fe3+的核外电子排布式为
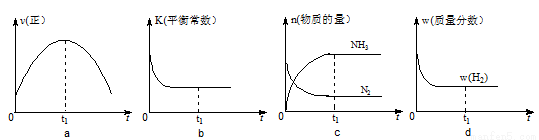
②500℃时,合成塔中的反应为:N2(g)+3H2(g) 2NH3(g) ?H= -92.4kJ/mol在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母编号)。
2NH3(g) ?H= -92.4kJ/mol在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母编号)。
(3)沉淀池中反应的化学方程式为
(4)在上述流程中可以循环使用的X是 (填化学式),从(NH4)2SO4溶液中获得 (NH4)2SO4晶体操作的步骤是是加热浓缩、 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三(补习班)10月月考理综化学试卷(解析版) 题型:选择题
下列关于药品的取用和保存,仪器选用正确的是
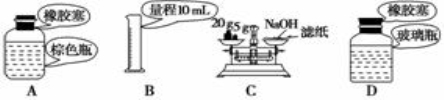
A.实验室中保存浓硝酸 B.准确量取9.50 mL稀硫酸
C.用托盘天平称量NaOH固体 D.实验室中保存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在pH=1的溶液中:K+、Na+、SO42–、 IO3-、I-
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42–
C.0.1 mol/L的NaNO3溶液:H+、Fe2+、Cl-、SO42-
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
下列有关晶体的说法中一定正确的是
①原子晶体中只存在非极性共价键
②稀有气体形成的晶体属于原子晶体
③干冰晶体升华时,分子内共价键会发生断裂
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键
A.①③ B.只有⑤ C.②④⑤ D.③⑤
查看答案和解析>>
科目:高中化学 来源:2015届吉林省长春外国语学校高三上学期期中理综化学试卷(解析版) 题型:选择题
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2  2NO,经测定前5 s用N2表示的反应速率为0.1 mol·L-1·s-1,则10 s末NO的浓度为
2NO,经测定前5 s用N2表示的反应速率为0.1 mol·L-1·s-1,则10 s末NO的浓度为
A.大于2 mol·L-1 B.2 mol·L-1
C.小于2 mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高三第三次月考化学试卷(解析版) 题型:填空题
(16分)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
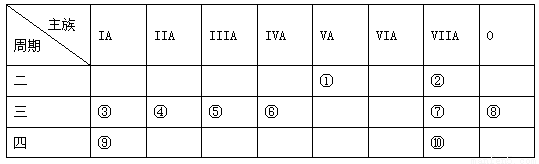
(1)在③~⑦元素中,原子半径最大的是 ,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的是 , 呈两性的氢氧化物是 ;
(3)按要求写出下列两种物质的电子式:①的氢化物 ;⑨的最高价氧化物的对应的水化物 ;
(4)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。
查看答案和解析>>
科目:高中化学 来源:2015届吉林省吉林市高三第一次摸底考试化学试卷(解析版) 题型:选择题
用含锌、银杂质的粗铜作阳极,纯铜作阴极,CuSO4溶液做电解液进行电解,下列有关电解液中Cu2+物质的量浓度的叙述中,正确的是
A.c(Cu2+)增大 B.c(Cu2+)减小 C.c(Cu2+)不变 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com