
【题目】将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生反应: 2A(g)+B(g) ![]() 2C(g),若经3s后测得C的浓度为0.6mol/L,现有下列几种说法:
2C(g),若经3s后测得C的浓度为0.6mol/L,现有下列几种说法:
①用物质A表示的反应的平均速率为0.6 mol/(L·s)
②用物质B表示的反应的平均速率为0.1mol/(L·s)
③3s时物质A的转化率为70%
④3s时物质B的浓度为0.7 mol/L。其中正确的是
A.①③B.②③C.②④D.①④
科目:高中化学 来源: 题型:
【题目】25℃时,在浓度都为1 mol·L-1的(NH4)2SO4、NH4H CO3、NH4HSO4、NH4Cl的四种溶液中,测得c(NH4+)分别为a、b、c、d(单位为mol·L-1)。下列判断正确的是
A. a=2b=2c=2d B. a>b>c> d C. a>c>d>b D. a>c>b>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种同位素X的原子质量数为A,含N个中子,它与![]() 原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
A. ![]() (A-N+m)molB.
(A-N+m)molB. ![]() (A-N)molC.
(A-N)molC. ![]() (A-N)molD.
(A-N)molD. ![]() (A-N+m)mol
(A-N+m)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨晶体晶胞的结构模型如下图所示。实验测得金属钨的密度为19.30![]() 已知钨的相对原子质量为183.8。回答下列问题:
已知钨的相对原子质量为183.8。回答下列问题:
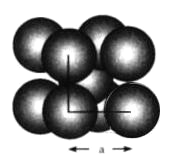
(1)在钨晶体中每个晶胞占有的钨原子数为__________个。
(2)钨晶体晶胞的边长为![]() __________
__________![]() 。
。
(3)钨原子的半径为__________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.铜粉加入氯化铁溶液中:Cu + Fe3+ = Fe2++Cu2+
B.将稀硫酸滴在铜片上:Cu + 2H+ =Cu2++ H2↑
C.氯气与烧碱溶液反应:Cl2+2OH-=ClO-+Cl-+H2O
D.将少量铜屑放入稀硝酸中:Cu+4H++2NO![]() = Cu2++2NO2↑+2H2O
= Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“试剂”和“烧杯中的物质”不能完成“实验目的”的是


实验目的 | 试剂 | 烧杯中的物质 | |
A | 醋酸的酸性强于苯酚 | 碳酸氢钠溶液 | ①醋酸 ②苯酚溶液 |
B | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯 ②苯酚溶液 |
C | 甲基对苯环的活性有影响 | 酸性高锰酸钾溶液 | ①苯 ②甲苯 |
D | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 | 金属钠 | ①水 ②乙醇 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为_____________。
(2)由A、B、W三种元素组成的18电子微粒的电子式为______________。
(3)若要比较D与E的金属性强弱,下列实验方法可行的是____________。
A. 将单质D置于E的盐溶液中,若D不能置换出单质E,说明D的金属性弱
B. 比较D和E的最高价氧化物对应水化物的碱性,前者比后者强,故前者金属性强
C. 将D、E的单质分别投入到同浓度的盐酸中,观察到D反应更剧烈,说明D的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性溶液中分解产生S、SO2。
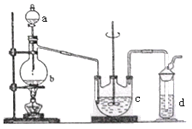
Ⅰ. Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得,实验室模拟该工业过程的装置如图所示。
(1)b中反应的离子方程式为________,c中试剂为_________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_______。
(3)实验中要控制SO2生成速率,可以采取的措施有___________(写出两条)。
(4)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______。
(5)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:___________________________________。
Ⅱ. 探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)
Fe(S2O3)33-(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O32-
装置 | 编号 | 试剂X | 实验现象 |
| ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色, 30s后溶液几乎变为无色 |
② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(6)根据实验①的现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过____(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:____。
(7)同浓度氧化性:Ag+ > Fe3+。实验②中Ag+未发生氧化还原反应的原因是____。
(8)进一步探究Ag+和S2O32-反应。
装置 | 编号 | 试剂X | 实验现象 |
| ③ | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:Ag2S2O3+_____ =Ag2S+_____
(9)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和____有关(写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某配位化合物为深蓝色晶体,由原子序数由小到大的A,B,C,D,E五种元素组成,其原子个数比为14∶4∶5∶1∶1。其中C,D同主族且原子序数D为C的2倍,E元素的外围电子排布式为(n-1)dn+6ns1,试回答下列问题:
(1)该配位化合物的化学式为________________________,配合物中采取sp3杂化的原子按第一电离能由大到小排列顺序为______________(用元素符号表示),1mol配离子中含有的σ键数目为_________________。
(2)D元素基态原子的最外层电子排布图为_______________________________。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为_________________________________。
(4)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为________,该分子中B元素的杂化方式为________。
(5)该配合物溶于水得深蓝色溶液,加入乙醇溶剂,将析出深蓝色的晶体,则加入乙醇的作用是____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com