
| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | [F-]>[CN -] |
分析 HF的酸性比HCN的酸性强,HF的电离程度大于HCN,则其酸根离子水解程度F-<CN-,相同温度下,物质的量浓度和体积均相同的NaF和NaCN两种溶液中两种盐的物质的量相等,溶液中存在电荷守恒和物料守恒,根据电荷守恒判断.
解答 解:HF的酸性比HCN的酸性强,HF的电离程度大于HCN,则其酸根离子水解程度F-<CN-,相同温度下,物质的量浓度和体积均相同的NaF和NaCN两种溶液中两种盐的物质的量相等,
根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(F-)、c(Na+)+c(H+)=c(OH-)+c(CN-),两种溶液中离子浓度分别是其溶液中所有阳离子浓度的2倍,
因为酸根离子水解程度F-<CN-,则c(F-)>c(CN-),所以NaF溶液中氢离子浓度大于NaCN,两种溶液中钠离子浓度相等,
所以NaF溶液中离子个数大于NaCN离子个数,即n1>n2,
故选B.
点评 本题以离子个数比较为载体考查了盐类水解,题目难度中等,明确电离平衡常数与酸根离子水解程度的关系是解本题关键,然后再采用电荷守恒、离子代换等方法来分析解答.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
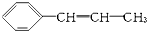 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为 | |
| D. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
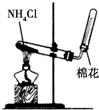 |  | 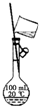 | 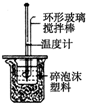 |
| A.实验室制取氨气 | B.测定反应速率装置 | C.配制100 mL 0.1 mol/L盐酸 | D.测定中和反应的反应热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尼古丁是由26个原子构成的物质 | |
| B. | 尼古丁中C、H、N 三种元素的质量比为:10:14:2 | |
| C. | 尼古丁的相对分子质量是162g | |
| D. | 尼古丁中氮元素的质量分数为17.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
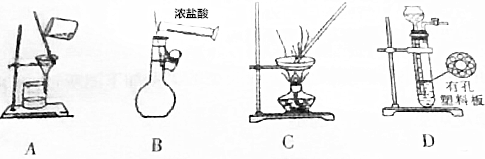
| A. | 用图a所示装置用除去淀粉溶液中的NaCl | |
| B. | 用图b所示装置配制100mL0.100mol•L-1稀盐酸 | |
| C. | 图c所示装置可用于从碘水中分离出I2 | |
| D. | 图d所示装置可用于CaCO3和稀盐酸制取少量的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ④⑤⑥ | C. | ①②④ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫完全燃烧生成二氧化硫时,放出的热量为硫的标准燃烧热 | |
| B. | 在101kPa时,1mol碳燃烧所放出的热量为碳的标准燃烧热 | |
| C. | 在101kPa时,由2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,可知CO的标准燃烧热为283 kJ•mol-1 | |
| D. | 乙炔的标准燃烧热为1299.6 kJ•mol-1,则2CH2(g)+5O2(g)═4CO2(g)+2H2O(g)反应的△H=-2 599.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3 | B. | KMnO4 | C. | MnO2 | D. | Ca(ClO)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com