
 时铜电极质量增加2.16 g,试讨论:
时铜电极质量增加2.16 g,试讨论: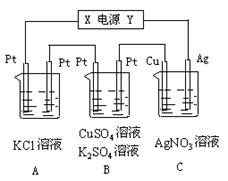
 00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________
00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________ 。
。科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.小于7 | B.大于7 | C.等于7 | D.大于或等于7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
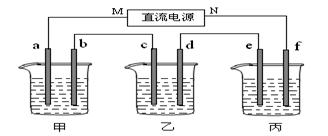
 (1)电源的N端为 极;
(1)电源的N端为 极;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
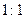 ,电解质可能为 。
,电解质可能为 。 H2放出,则电解质可能为 。
H2放出,则电解质可能为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
 Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。 Cr3+
Cr3+ Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.13 | B.12 | C.8 | D.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| | 阳极 | 阴极 | 溶液甲 | 物质乙 |
| A. | 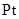 | 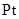 | 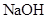 | 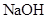 固体 固体 |
| B. | 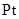 | 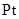 | H2SO4 | H2O |
| C. | 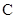 | 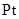 | 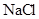 | 稀盐酸 |
| D] | 粗铜 | 精铜 | CuSO4 | Cu(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com