

分析 BaS溶液加入工业盐酸酸化,转化为氯化钡溶液,脱硫是除去溶液中溶解的硫化氢,调节溶液pH使溶液中铁离子转化为氢氧化铁沉淀,过滤除去,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤等操作得到二水氯化钡晶体.
(1)操作I是从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤等操作;
(2)铁离子具有较强的氧化性,可以氧化硫化氢生成硫,还原得到亚铁离子;
(3)①脱硫是脱去溶液中溶解的硫化氢,物理脱硫除去的为硫化氢;
②利用氧化脱硫,选择的氧化剂不能引入新杂化;
(4)由信息可知,CaCN2与硫化氢在80-85℃时反应生成CS(NH2)2、氢氧化钙,反应有水参加.
解答 解:BaS溶液加入工业盐酸酸化,转化为氯化钡溶液,脱硫是除去溶液中溶解的硫化氢,调节溶液pH使溶液中铁离子转化为氢氧化铁沉淀,过滤除去,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤等操作得到二水氯化钡晶体.
(1)操作I是从溶液中获得二水氯化钡晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤等操作,
故答案为:蒸发浓缩、冷却结晶;
(2)铁离子具有较强的氧化性,可以氧化硫化氢生成硫,还原得到亚铁离子,反应离子方程式为:2Fe3++H2S=S↓+2H++2Fe2+,
故答案为:2Fe3++H2S=S↓+2H++2Fe2+;
(3)①脱硫是脱去溶液中溶解的硫化氢,物理脱硫是直接用蒸汽升温,并用空气“爆气法”出去的物质是硫化氢,
故答案为:硫化氢;
②利用氧化脱硫,选择的氧化剂不能引入新杂化,高锰酸钾、重铬酸钾、次氯酸钾都会引入杂质离子,氯气与氯气反应生成HCl,与硫沉淀,不引入杂质离子,故选:B;
(4)由信息可知,CaCN2与硫化氢在80-85℃时反应生成CS(NH2)2、氢氧化钙,反应有水参加,反应方程式为:CaCN2+H2S+2H2O$\frac{\underline{\;80~85℃\;}}{\;}$CS(NH2)2+Ca(OH)2,
故答案为:CaCN2+H2S+2H2O$\frac{\underline{\;80~85℃\;}}{\;}$CS(NH2)2+Ca(OH)2.
点评 本题考查实验制备方案工艺流程,涉及物质的分离提纯、方程式书写等,明确工艺流程原理是解题关键,难度中等.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 与溴水发生取代,反应产物的结构简式是CH3CBr2CH3 | |
| B. | 一定条件下能与水加成,产物是混合物 | |
| C. | 一定条件下能加聚合成  | |
| D. | 丙烯能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeBr2溶液中滴入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| B. | 酸性条件下,FeSO4溶液与H2O2反应:Fe2++2H++H2O2=Fe3++2H2O | |
| C. | SO2通入Ca(ClO)2溶液中:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO | |
| D. | NaAlO2溶液与NaHCO3溶液混合:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
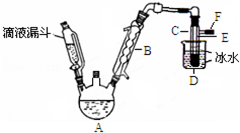 如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:
如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式: | |
| B. | 镁的原子结构示意图为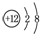 | |
| C. | 氯化氢分子的形成过程可用电子式表示为:H×+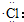 →H+[ →H+[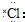 ]- ]- | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
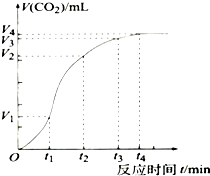 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图).请分析讨论以下问题.
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图).请分析讨论以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 极性分子中一定没有非极性键 | B. | 非极性分子中一定不含极性键 | ||
| C. | 单质分子中一定存在非极性键 | D. | 极性分子中一定有极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com