
HArF是第一个被发现的氩化合物,其分子的比例模型如图所示,在HArF中氟为-l价,氩为0价,其水溶液显强酸性,酸性与盐酸相当。下列有关说法错误的是( )

A.稀有气体在一定条件下也可发生化学反应
B.HAlF为极性分子
C.ArF-具有较强的氧化性
D.向HArF溶液中加入NaOH,反应的离子方程式为:H++OH-=H2O
科目:高中化学 来源: 题型:
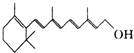 维生素A是复杂机体必需的一种营养素,也是最早被发现的一种维生素,如果儿童缺乏维生素A时,会出现夜盲症,并可导致全身上皮组织角质变性等病变.已知维生素A的结构简式如图,关于它的正确说法是( )
维生素A是复杂机体必需的一种营养素,也是最早被发现的一种维生素,如果儿童缺乏维生素A时,会出现夜盲症,并可导致全身上皮组织角质变性等病变.已知维生素A的结构简式如图,关于它的正确说法是( )| A、维生素A分子式为C20H32O | B、维生素A是一种极易溶于水的醇 | C、维生素A在铜作催化剂加热的条件下可以发生催化氧化反应生成一种醛 | D、1mol维生素A最多可以和6mol氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
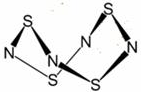 Ⅰ.S4N4的结构如图:
Ⅰ.S4N4的结构如图:
查看答案和解析>>
科目:高中化学 来源: 题型:
A.尿素是一种氮肥
B.尿素是人体新陈代谢的一种产物
C.尿素能发生水解反应
D.尿素是一种酸性物质
查看答案和解析>>
科目:高中化学 来源: 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com