
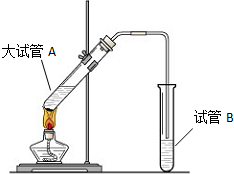
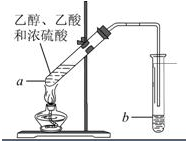
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:分析 (1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(3)导管伸入液面下可能发生倒吸;
(4)分离互不相溶的液体,可用分液的方法分离;
(5)液体加热要加碎瓷片,防止暴沸;
(6)反应的方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,根据乙酸和乙醇的质量关系判断反应的过量问题,结合方程式计算.
解答 解:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应;
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)吸收乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:中和乙酸、吸收乙醇,降低乙酸乙酯的溶解度,有利于酯的分离;
(3)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:防止倒吸;
(4)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯;
故答案为:分液;
(5)液体加热要加碎瓷片,引入汽化中心,可防止溶液暴沸,
故答案为:防止暴沸;
(6)30g乙酸的物质的量为$\frac{30g}{60g/mol}$=0.5mol,46g乙醇的物质的量为$\frac{46g}{46g/mol}$=1mol,
反应的方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,由此可知乙醇过量,
则CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
1mol 1mol
0.5mol×67% n
n=0.5mol×67%=0.335mol,
m(CH3COOCH2CH3)=0.335mol×88g/mol=29.5g,
故答案为:B
点评 本题考查了乙酸乙酯的制备方法、可逆反应特点,题目难度中等,注意掌握乙酸乙酯的反应原理及制备方法,明确可逆反应特点,浓硫酸、饱和碳酸钠溶液、长导管在酯化反应中的作用为考查的热点,要求学生熟练掌握.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.氧化还原反应一定有氧元素参加 B.氧化剂本身发生氧化反应
C.氧化反应一定先于还原反应发生 D.一定有电子转移(得失或偏移)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| Al(OH)3 | 3.7 | 5.7 |
| 开始溶解:7.8 | 完全溶解:10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ | |
| B. | 平衡时v正(O2)=v逆(NO) | |
| C. | 平衡后降低压强,混合气体平均摩尔质量增大 | |
| D. | 平衡后升高温度,混合气体中NO含量降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
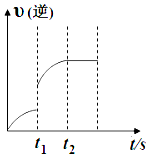 已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )
已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )| A. | t1时改变的条件可能是使用催化剂 | |
| B. | t1时改变的条件可能是增大 H2O 浓度 | |
| C. | t1~t2这段时间内的化学反应速率 v(H2O)=$\frac{{t}_{2}-{t}_{1}}{0.15}$ | |
| D. | t2后继续加入 2 mol C(s)平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | H2SO3 | NH3•H2O |
| 电离常数K(25℃) | Ka=1.8×10-5 | Ka1=1.23×10-2;Ka2=6.6×10-8 | Kb=1.8×10-5 |
| A. | Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO32-+2CH3COOH=SO2↑+H2O+2CH3COO- | |
| B. | 25℃时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离被促进 | |
| C. | NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2 | |
| D. | 0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中的微粒存在以下关系:c(H+)+c(CH3COOH)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com