

���� ��1����ѧ��Ӧ�ȡ�H=��Ӧ���ܼ���-�������ܼ��ܼ��㷴Ӧ�ȣ�
��2�����������仯ͼ���㷴Ӧ�ȣ���Ӧ��=��Ӧ��ļ��ܺ�-������ļ��ܺͣ��Ӷ���д�Ȼ�ѧ����ʽ��
�ڷ�Ӧ�Է����е��ж������ǡ�H-T��S��0��
��� �⣺��1����Ӧ�ȡ�H=��Ӧ���ܼ���-�������ܼ��ܣ����Զ���S��s��+3F2��g���TSF6��g�����䷴Ӧ�ȡ�H=280kJ/mol+3��160kJ/mol-6��330kJ/mol=-1220kJ/mol��
�ʴ�Ϊ��-1220kJ/mol��
��2���ٸ÷�Ӧ�еķ�Ӧ��=��Ӧ��ļ��ܺ�-������ļ��ܺ�=��945+498��kJ/mol-2��630kJ/mol=+183kJ/mol������N2��O2��Ӧ����NO���Ȼ�ѧ��Ӧ����ʽΪN2��g��+O2��g��=2NO��g����H=+183kJ•mol-1��
�ʴ�Ϊ��N2��g��+O2��g��=2NO��g����H=+183KJ/mol��
����֪�÷�Ӧ�ġ�S��247.7J•mol-1•K-1����H=+183KJ/mol����Ӧ�Է�������Ҫ�����H-T��S��0���������õ���+183KJ/mol-T��247.7��10-3KJ•mol-1•K-1��0��
T��739K���¶�t=739-273=466��C�������²����Է����У�
�ʴ�Ϊ�����ܣ�
���� ���⿼���˷�Ӧ�����仯�ļ��㡢��Ӧ�Է����е��ж����ݣ���Ӧ��=��Ӧ��ļ��ܺ�-������ļ��ܺͣ����ջ����ǽ���ؼ�����Ŀ�ѶȲ���


 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+��Ba2+��AlO2-��NO3- | B�� | K+��Na+��HSO3-��Cl- | ||
| C�� | NH4+��K+��Cl-��NO3- | D�� | Fe3+��Na+��ClO-��S2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
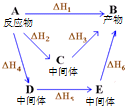
| A�� | ���ΪC4H8�Ļ��������ʶ���ͬ | |
| B�� | �ⵯԭ��D��T������${\;}_1^1$H�ڻ�ѧ��Ӧ����ȡ | |
| C�� | ��ͭ��⾫��ʱ���������ٵ�����һ�������������ӵ����� | |
| D�� | ͼ������A����ͬ;������Bʱ���ʱ����㣺��H1=��H2+��H3=��H4+��H5+��H6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
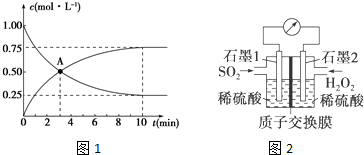
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������Ԫ��Q��R��T��W��Ԫ�����ڱ���λ����ͼ��ʾ������T��������������������������ȣ�
������Ԫ��Q��R��T��W��Ԫ�����ڱ���λ����ͼ��ʾ������T��������������������������ȣ� ��R������⻯��ĵ���ʽΪ
��R������⻯��ĵ���ʽΪ ��Q��1��1���⻯������Է���������С�ķ�����ֱ���ͷ��ӣ����幹�ͣ���
��Q��1��1���⻯������Է���������С�ķ�����ֱ���ͷ��ӣ����幹�ͣ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
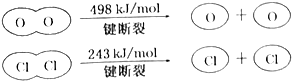
| A�� | ��ӦA�ġ�H��-115.6kJ•mol-1 | |
| B�� | H2O��H-O����HCl��H-Cl���� | |
| C�� | ��II�е������ж���Ԫ�صķǽ����Ա���Ԫ��ǿ | |
| D�� | �Ͽ�1molH-O����Ͽ�1molH-Cl�������������31.9kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢� | C�� | �ڢ� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com