
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。我国科学家开发的一种“磷酸钒锂/石墨锂离子电池”在4.6 V电位区电池总反应为:Li3C6+V2(PO4)3![]() 6C+Li3V2(PO4)3,下列有关说法正确的是( )
6C+Li3V2(PO4)3,下列有关说法正确的是( )
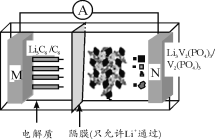
A.用Li3V2(PO4)3作负极材料
B.放电过程中,当外电路中通过0.1 mol电子时M极质量减少0.7 g
C.充电时,Li+向N极区迁移
D.充电时,N极反应为V2(PO4)3+3Li++3e-=Li3V2(PO4)3
【答案】B
【解析】
A. 根据电池放电总反应为:Li3C6+V2(PO4)3=6C+ Li3V2(PO4)3,Li3C6发生失去电子的氧化反应,M电极为负极,N电极为正极,由装置图可知Li3V2(PO4)3作正极材料,A错误;
B. 放电时,M电极为负极,反应式为Li3C6-3e-=6C+3Li+,即外电路中通过0.1 mol电子,M极有0.1 mol Li生成Li+转移到正极N极,即M减少0.1 mol Li,质量为7 g/mol×0.1 mol=0.7 g,B正确;
C. 充电时,N电极为阳极、M电极为阴极,Li+由阳极N区向阴极M极区迁移,C错误;
D. 放电时N电极为正极,充电时N电极为阳极,电极反应式为Li3V2(PO4)3-3e-= V2(PO4)3+3Li+,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】关于银镜反应的实验操作步骤如下:
A.在试管中先注入少量NaOH溶液,振荡,加热煮沸之后把NaOH溶液倒去,再用蒸馏水洗净试管备用
B.在洗净的试管里配制银氨溶液
C.向银氨溶液中滴入3~4滴乙醛稀溶液
D.加热
请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是_____________________________;
(2)简述银氨溶液的配制过程:__________________________________________;
(3)写出乙醛发生银镜反应的化学方程式:_____________________________________;
(4)银氨溶液久置可能会爆炸,直接排放会污染环境,且造成资源浪费,实验室从废液中回收银的实验流程如下:![]()
已知:[Ag(NH3)2]+![]() Ag++2NH3
Ag++2NH3
①写出废液与稀硝酸反应的离子方程式:__________________________________;
②加入铁粉要过量的目的是___________________________________________.
③该实验过程中可能产生的大气污染物是________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20molL-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010molL-1KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①、②是探究__________对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__________;乙是实验需要测量的物理量,则表格中“乙”应填写__________。
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取1.260 g纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05 000 mol·L-1的KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式_____________________。
(3)某学生的滴定方式(夹持部分略去)如图,最合理的是___________(选填 a、b)。
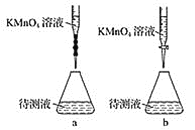
(4)由图可知消耗KMnO4溶液体积为________________mL。

(5)滴定过程中眼睛应注视______。
(6)通过上述数据,求得x=_______。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液洗滴定管,引起实验结果_____________(偏大、偏小或没有影响) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个体积相同的密闭容器A、B,在A中充入SO2和O2各1mol,在B中充入SO2和O2各2mol,加热到相同温度,有如下反应2SO2(g)+O2(g)![]() 2SO3(g),对此反应,下述不正确的是
2SO3(g),对此反应,下述不正确的是
A. 反应速率B>A B. SO2的转化率B>A
C. 平衡时各组分含量B=A D. 平衡时容器的压强B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在防治新冠肺炎的工作中,过氧乙酸(CH3COOOH)是众多消毒剂中的一种。过氧乙酸具有强氧化能力,可将各种病原微生物杀灭。其性质不稳定,遇热易分解。某同学利用高浓度的双氧水和冰醋酸制备少量过氧乙酸并进行相关实验。
I.过氧乙酸的制备.
向100mL的三颈烧瓶中加入25mL冰醋酸,滴加42.5%双氧水15mL,之后加入一定量浓硫酸,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。
(1)三颈烧瓶中制取过氧乙酸的反应方程式为____。
(2)资料显示浓硫酸的用量对制得的过氧乙酸的质量分数有较为明显的影响,如图所示。根据图中数据分析本实验中浓硫酸的用量应为____(填字母)。
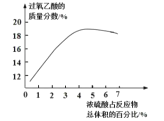
a 1.5mL-2.0mL b 3.5mL-4.0mL C 5.5mL-6.0mL
II.过氧乙酸质量分数的测定
准确称取1.00g过氧乙酸样液,定容子100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知:![]() )。
)。
(3)加入过量KI溶液前,需除去H2O2的原因是____(用离子方程式表示)。
(4)滴定时所选指示剂为____;制得过氧乙酸溶液中过氧乙酸质量分数为____%。
(5)过氧乙酸用于消毒时,要将原液稀释到0.2%-0.5%之间。若实验室配制1000mL过氧乙酸稀溶液时,除需使用烧杯和玻璃棒外,还要用到以下哪些仪器____(填标号)。
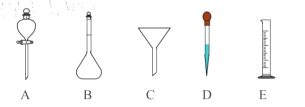
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将H2(g)和I2(g)各1 mol的气态混合物充入2 L的密闭容器中,充分反应,5 min后达到平衡,测得c(HI)=0.2 mol/L。
(1)计算从反应开始至达到平衡,用H2(g)表示的反应速率。
(2)求该反应的平衡常数。
(3)保持温度不变,若向上述容器中充入H2(g)和I2(g)各2 mol,求达到平衡时I2(g)的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙可由如图反应得到,则丙的结构不可能是
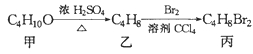
A. CH3CBr2CH2CH3B. (CH3)CBrCH2Br
C. CH3CH2CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定压强下,向10 L密闭容器中充入1 mol S2Cl2和1 mol Cl2,发生反应S2Cl2(g)+Cl2(g) ![]() 2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是( )
2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是( )
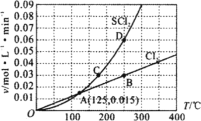
A.正反应的活化能大于逆反应的活化能
B.达到平衡后再加热,平衡向逆反应方向移动
C.A、B、C、D四点对应状态下,达到平衡状态的为B、D
D.一定温度下,在恒容密闭容器中,达到平衡后缩小容器体积,重新达到平衡后,Cl2的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室进行如下实验探究活动。
(1)设计如下实验研究2Fe3++2I-![]() 2Fe2++I2的反应。
2Fe2++I2的反应。

①振荡静置后C中观察到的现象是_______________________;为证明该反应存在一定限度,还应补做实验为:取C中分液后的上层溶液,然后______________(写出实验操作和现象)。
②测定上述KI溶液的浓度,进行以下操作:
I用移液管移取20.00 mL KI溶液至锥形瓶中,加入适量稀硫酸酸化,再加入足量H2O2溶液,充分反应。
II小心加热除去过量的H2O2。
III用淀粉做指示剂,用c mol/L Na2S2O3标准溶液滴定,反应原理为:2Na2S2O3+I2=2NaI+Na2S4O6。
步骤II是否可省略?____________(答“可以”或“不可以”)
步骤III达到滴定终点的现象是___________________________。巳知I2浓度很高时,会与淀粉形成稳定的包合物不易解离,为避免引起实验误差,加指示剂的最佳时机是________。
(2)探究Mn2+对KMnO4酸性溶液与H2C2O4溶液反应速率的影响。
反应原理(化学方程式)为________;
仪器及药品:试管(两支)、0.01 mol/L KMnO4酸性溶液、0.1 mol/L H2C2O4溶液、一粒黄豆大的MnSO4固体;
实验方案:请仿照教材(或同教材)设计一个实验用表格,在行标题或列标题中注明试剂及观察或记录要点。______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com