
| A. | SO2具有漂白性 | B. | SO2为酸性氧化物 | C. | SO2具有还原性 | D. | SO2具有氧化性 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 若反应中转移的电子数可能为$\frac{1}{3}$mol | |
| C. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为7﹕6 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
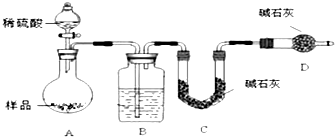
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量排放NO和NO2等氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| B. | 采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路” | |
| D. | 大量燃烧化石燃料排放的废气中含大量SO2,从而使雨水的pH=5.6,形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol/L Na2C2O4溶液中:c(OH-)═c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| B. | 含等物质的量的NaHCO3和Na2CO3的溶液中:3c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] | |
| C. | 二元酸H2A在水中发生电离:H2A=H++HA-和HA-?H++A2-,则NaHA溶液中:c(Na+)>c(HA-)>c(OH-)>c(H+) | |
| D. | 含有AgCl和AgI固体的悬浊液:c(Cl-)<c(I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-的电子式: | |
| B. | 乙酸的分子式C2H4O2 | |
| C. | 硫离子结构示意图 | |
| D. | 氢氧化钡电离方程式:Ba(OH)2═Ba2++OH2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com