
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
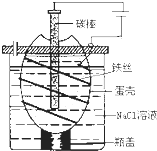 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com