
分析 根据M=ρ×Vm计算出该烃的摩尔质量,然后根据n=$\frac{m}{M}$计算出该气态烃及二氧化碳的物质的量,然后结合质量守恒可确定该烃中含有C原子数,最后根据其摩尔质量确定其分子中含有H原子数,从而得出其分子式.
解答 解:该烃的密度在标准状况下是1.96g/L,则该烃的摩尔质量为:M=ρ×Vm=1.96g/L×22.4L/mol≈44g/mol,
8.8g该气态烃的物质的量为:n=$\frac{8.8g}{44g/mol}$=0.2mol,
26.4g二氧化碳气体的物质的量为:$\frac{26.4g}{44g/mol}$=0.6mol,
则该烃分子中含有C原子数为:N(C)=$\frac{0.6mol}{0.2mol}$=3,
该烃分子中含有H原子数为:N(H)=$\frac{44-12×3}{1}$=8,
所以该烃的分子式为:C3H8,
答:该烃的分子式为C3H8.
点评 本题考查了有机物分子式的计算,题目难度不大,明确标况下密度与摩尔质量之间的关系为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用方法.


科目:高中化学 来源: 题型:选择题

| A. | 铜片是负极 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从锌片经导线流向铜片 | |
| D. | 有6.02×1022个电子经过导线时,锌片质量减少3.25g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式: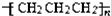 | B. | 乙醇的结构简式:CH3CH2OH | ||
| C. | 四氯化碳的电子式: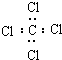 | D. | -CH3(甲基)的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡后静置,下层液体未褪色 | |
| C. | 1mol苯能与3mol H2发生加成反应,说明在苯环中含有3个双键 | |
| D. | 用冰冷却苯,苯可以凝结成无色的晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
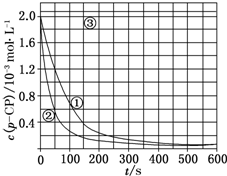 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
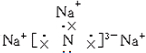 ,该化合物由离子键形成.
,该化合物由离子键形成.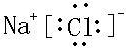 ,
, .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com