
【题目】锌-空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时下列说法正确的是

A. 氧气在石墨电极上发生氧化反应
B. 该电池的负极反应为Zn+H2O-2e- = ZnO+2H+
C. 该电池充电时应将Zn电极与电源负极相连
D. 该电池放电时OH-向石墨电极移动
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不能满足组内任意两种物质在一定条件下均能发生反应的是
物质 | 甲 | 乙 | 丙 |
A | H2SO4 | NH4HCO3 | Ba(OH)2 |
B | H2S | NaOH | SO2 |
C | NH3 | NO2 | HNO3 |
D | Na | H2O | Cl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置或操作进行相应实验,能达到实验目的的是

A. 用图1所示装置收集SO2气体
B. 用图2所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
C. 用图3所示装置从食盐水中提取NaCl
D. 用图4所示装置制取并收集O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列方框中对应的物质或有关叙述正确的是( )
![]()
A. Na2S4O6、H2O、Na2S2O3、Au2O、NaOH B. Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C. Na2S2O3、H2O、Na2S4O6、Au2O、NaOH D. 当1 mol Au2O3完全反应时,转移电子8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
(1)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
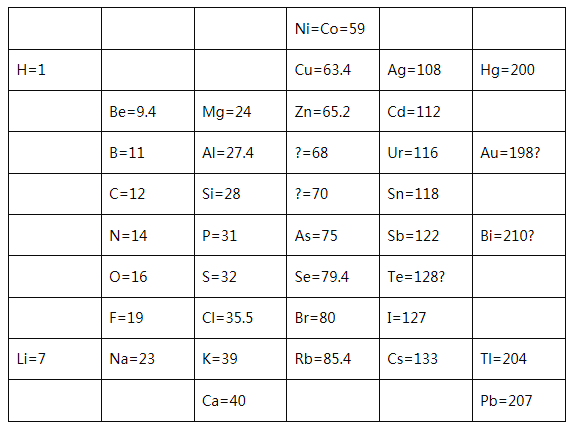
①门捷列夫将已有元素按照相对原子质量排序,同一_________(填“横行”或“纵列”)元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是______,第5列方框中“Te=128?”的问号表达的含义是________。
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是_____(填字母序号)。
A. 随着核电荷数递增,元素主要化合价呈现周期性变化
B. 随着核电荷数递增,原子核外电子排布呈现周期性变化
C. 随着核电荷数递增,原子半径呈现周期性变化
(2)短周期元素A、B、D、E、G、J在周期表中的位置如下:
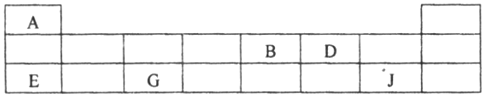
根据上表回答问题:
①第三周期的四种元素中离子半径最小的是_________ (用元素符号填答)。
②B、D的非金属性由大到小的顺序是__________ (用元素符号填答)。
③E、G、J的最高价氧化物对应水化物两两之间反应的离子方程式分别为i.H++OH-=H2O、ii.___、iii.___。
④用电子式表示A2D形成过程_______________。
(3)元素Y的一种含氧酸化学式为 H3YO3,其结构式可表示为:![]() 。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式_____。(用对应元素符号填答)(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式_____。(用对应元素符号填答)(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe2+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲。
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g。
③第二份加足量BaCl2溶液后,得白色沉淀,加盐酸不溶解,经过滤、洗涤、干燥后,称得沉淀质量为13.98g。
(1)由上述实验可确定溶液中一定不存在的离子是______________,不能确定是否存在的离子是_______,检验该离子需使用何种试剂或方法______________。
(2)由题意可知此溶液呈________性(答酸性、碱性或中性),上述金属离子中既能被氧化又能被还原的离子是___________。
(3)钾离子是否存在(是或否):_______,若存在其浓度范围为(没有则不答):_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.新制氯水能使品红溶液褪色,说明Cl2具有漂白性
B.富含硫单质的矿物在工业上可用于制造硫酸
C.硫粉在过量的纯氧中燃烧可以生成大量的SO3
D.常温时将Fe片放入浓硫酸,无明显现象是因为Fe和浓硫酸不反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com