
【题目】将纯锌片和纯铜片按下图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
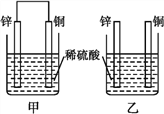
(1)下列说法中正确的是____(填序号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减小、乙中锌片质量减小 D.两烧杯中H+的浓度均减小
(2)当甲中产生1.12 L(标准状况)气体时,理论上通过导线的电子数目为____。
(3)当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L1。试确定原稀硫酸中c(H2SO4)=___________。
(4)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池总反应的化学方程式:________________________。
(5)以甲醇(CH3OH)为燃料的电池中,电解质溶液为酸性,负极的反应式为:_______________________,正极的反应式为:___________________________。
【答案】 BD 0.1NA 1mol/L 2Zn+Ag2O2+4KOH+2H2O=2K2Zn(OH)4+2Ag 2CH3OH-12e﹣+2H2O=12H﹢+2CO2↑ 3O2+12e﹣+12H﹢=6H2O
【解析】(1)A.甲构成原电池,化学能转变为电能,乙不能,A错误;B.乙中锌与稀硫酸之间反应,铜片上没有明显变化,B正确;C.甲中锌是负极,铜是正极,正极上氢离子放电,所以铜片质量不变,乙中锌片质量减小,C错误;D.两烧杯中均消耗氢离子,H+的浓度均减小,D正确,答案选BD。(2)当甲中产生1.12 L(标准状况)气体时,氢气的物质的量是0.05mol,所以理论上通过导线的电子数目为0.1NA。(3)当乙中产生1.12 L(标准状况)气体时,氢气的物质的量是0.05mol,消耗硫酸是0.05mol。将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L1,氢离子是0.1mol,则剩余硫酸的物质的量是0.05mol,所以原稀硫酸中c(H2SO4)=0.1mol÷0.1L=1mol/L;(4)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,因此该电池总反应的化学方程式为2Zn+Ag2O2+4KOH+2H2O=2K2Zn(OH)4+2Ag。(5)以甲醇(CH3OH)为燃料的电池中,电解质溶液为酸性,负极发生甲醇失去电子的氧化反应,负极的反应式为2CH3OH-12e﹣+2H2O=12H﹢+2CO2↑,正极发生氧气得到电子的还原反应,正极的反应式为3O2+12e﹣+12H﹢=6H2O。


科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示.下列说法中,正确的是( ) 
A.W的最高价氧化物对应的水化物是强酸
B.Y的原子半径在同周期主族元素中最大
C.W的非金属性比Z的弱
D.Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,其学名、俗名及化学式不相符合的是( )
A. 碳酸钠、纯碱、Na2CO3 B. 碳酸氢钠、小苏打、NaHCO3
C. 氢氧化钠、火碱、NaOH D. 碳酸钙、生石灰、CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活和生产中应用广泛。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g) ![]() H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)
H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1) ![]() H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)
H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) ![]() H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
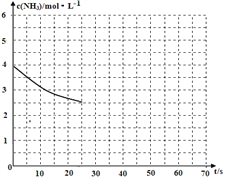
② 若保持温度和容器体积不变,向平衡体系中再通入2molNH3和2molH2O,此时v正______v逆(填“>”、“=”或“<”)
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业 生产NaN3主要是在175℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式_______________________。
(4)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 J 是某种解热镇痛药,以 A 为原料的工业合成路线如下图所 示:

已知
分子式 B: C8H8O2 C:C8H7NO4 D:C6H5NO3 E :C6H7NO F:C9H11NO2 H:C6H 7O3
(1)写出同时符合下列条件的 F 的所有同分异构体的结构简式_____
①属 a—氨基酸:(a 碳上须含有氢原子) ② NMR 谱表明分子中含有苯环
(2)下列说法不正确的是_____
A.化合物 C 中含氧官能团有两种
B.化合物 E 既可以与 NaOH 反应又可以与 HCl 反应
C.化合物 F 能与 FeCl3 发生显色反应
D.化合物 J 的分子式为 C18H15NO5
(3)设计 G→H 的合成路线(用流程图表示,无机试剂任选)_____
(4)写出 I+F→J 的化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于H2在O2中燃烧反应的描述,正确的是( )
A.该反应属于放热反应
B.断开H﹣H键放出能量
C.形成O﹣H键吸收能量
D.反应后生成物总能量升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可再生能源和清洁能源将成为新能源的主力军,下列关于能源的叙述正确的是
A.化石燃料是可再生能源B.氢能、太阳能是清洁能源
C.化石燃料都是清洁能源D.海洋能、地热能是不可再生的清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。镁海水电池可为灯塔提供能源,其装置如图所示。下列有关镁海水电池的说法正确的是
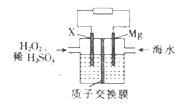
A. Mg电极上发生还原反应
B. 该电池工作一段时间后,左侧溶液质量减轻
C. 正极的电极反应式为H2O2+2e-+2H+=2H2O
D. 若电池工作时转移2 mol电子,则有2 mol H+由质子交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究土壤的酸碱性,某学生做了如下实验:将一定体积的蒸馏水加入一定质量的土壤中,充分搅拌后,过滤并留取滤液,测滤液的pH后向滤液中滴加氨水,每加入2mL氨水就搅拌均匀并测量溶液的pH,所得实验记录如下:
加氨水体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液的pH | 4 | 4 | 4 | 4 | 6 | 8 | 10 | 10 | 10 |
利用上述记录的数据,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图,并根据曲线图回答下列问题:
(1)所测土壤的酸碱性如何?
(2)所用氨水的pH和c(OH﹣)分别为多少?
(3)为使该滤液呈中性,所加入氨水的恰当体积是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com