
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
科目:高中化学 来源: 题型:
【题目】光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室常用来制备氯气的化学方程式为_____________________________________;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(ΔH)分别为-890.3kJ·mol-1、-285.8kJ.mol-1和-283.0kJ.mol-1,则生成1m3(标准状况)CO所需热量为________________;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为
____________________________________________;
(4)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g) ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):

①计算反应在第8min时的平衡常数K=__________________;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)_____T(8)
(填“<”、“>”或“=”),
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=_______mol·L-1;
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率(平均反应速率分别以v(2-3)、v(5-6)、v(12-13))的大小_______________________________________;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6)_____v(15-16)(填“<”、“>”或“=”),原因是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下将8.96 L氯化氢气体溶于水形成100 mL溶液,然后与足量的铁屑反应。
(1)所得盐酸溶液的物质的量浓度是多少________?
(2)参加反应的铁的质量是多少________?
(3)标况下生成氢气的体积是多少________?
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱除工业废气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g) ΔH=+180kJ·mol-1
2NO(g) ΔH=+180kJ·mol-1
③H2O(g)![]() H2O(l) ΔH=-44kJ·mol-1
H2O(l) ΔH=-44kJ·mol-1
写出常温下,NH3还原NO反应的热化学方程式__。
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3∶4,则脱除后NO转化为__。
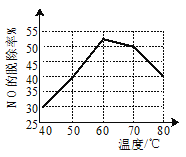
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示。图中,40~60℃NO脱除率上升可能的原因为__;60~80℃NO脱除率下降可能的原因为__。
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步:NaNO2继续被氧化为NaNO3,反应为![]() +
+![]() +2OH-
+2OH-![]()
![]() +2
+2![]() +H2O。
+H2O。
不同温度下,平衡时![]() 的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
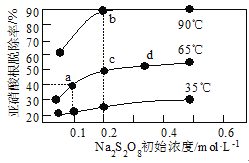
①a、b、c、d四点平衡常数K由大到小的顺序为__,原因是__。
②若a点(0.1,40%)时,![]() 的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=__。(用含a的代数式表示,已知65℃时Kw=1.0×10-13)
的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=__。(用含a的代数式表示,已知65℃时Kw=1.0×10-13)
(4)利用新型材料光催化脱除NO法如图所示。
某电化学小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应方程式为___。
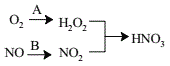
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较元素非金属性的相对强弱:![]() ________
________![]() (填“>”、“<”或“=”);用一个化学方程式说明
(填“>”、“<”或“=”);用一个化学方程式说明![]() 与
与![]() 氧化性的相对强弱________。
氧化性的相对强弱________。
(2)离子化合物![]() 可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出
可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)半导体材料单晶硅的熔点高、硬度大,主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol 电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是________,电子式是________________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是____________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子都达到了8e-稳定结构,该分子的电子式为____________,化学键类型为________________(填“离子键”、“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成________,其化学键类型为________;加热时生成________,其化学键类型为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com