
【题目】可逆反应2NO2![]() 2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : l 的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③ C. ①③④ D. ①②③④
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】
(1)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) = 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) = C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) = 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) = 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量(填“大于”、“等于”或“小于”)途径II放出的热量。
②b 与a、c、d的数学关系式是 。
(2)甲醇是一种重要的试剂,有着广泛的用途,工业上可利用CO2制备甲醇。用CH4与CO2反应制H2和CO,再利用H2和CO化合制甲醇。已知:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1450.0kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
③ 2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
则H2和CO制液态甲醇的热化学方程式为。
(3)如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.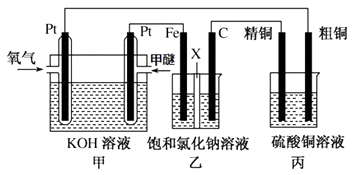
报据要求回答相关问题:
①写出甲中通甲醚一极的电极反应式。
②乙中发生的总反应的离子方程式为。
③将0.2mol AgNO3、0.4mol Cu(NO3)2 、0.6mol KCl溶于水,配成100ml溶液,用惰性电极电解一段时间后,某一电极上析出了0.3mol Cu,此时在另一电极上产生的气体体积(标准状况)为 L,若要使电解质溶液恢复到电解前的状态,需要加入固体的质量为g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物K是一种聚酯材料,合成路线如下:

己知:①AlCl3为生成A的有机反应的催化剂
②F不能与银氨溶液发生反应,但能与Na反应。
(1)生成A的有机反应类型为________。生成A的有机反应分为以下三步:
第一步:CH3COCl+AlCl3→CH3CO++AlCl4,
第二步:____________________
第三步:AlCl4-+H+→AlCl3+HCl
请写出第二步反应。
(2)B的化学名称为反应条件①为______________,反应条件②为_______________。
(3)由乙炔生成F的化学方程式为____________________。
(4)F的同分异构体很多,其中能同时满足这以下4个条件的链状化合物共有_________种(包括顺反异构和对映异构);
①含有三种官能团;②能与新制的Cu(OH)2悬浊液反应;③氧原子不与碳碳双键相连
④与Na反应可放出氢气
(5)K的结构简式为_________________。
(6)请以乙炔和丙酮为原料,按照加成、加成、消去的反应类型顺序三步合成天然橡胶的单体。(无机试剂任选)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境保护要求燃煤污染物控制排放,研究协同脱硫脱硝工艺是大势所趋。
Ⅰ量子化学计算能揭示出化学反应机理。
SO2与ClO2的气态反应中,因接触位置不同,形成了不同反应路径,反应中各驻点(TS为过渡态,RC、IM、PC为中间产物)相对初始反应物的能量关系如图1所示
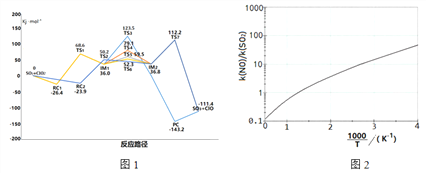
(1)写出该过程的热化学方程式:____________________。
(2)图中IM1→IM2,经历过渡态_____的路径反应速率最慢,其原因是______。
(3)在图中描线指出该反应的最优微观路径。____________
(4)产物ClO也有强氧化性,可以继续氧化SO2。请写出该反应的化学方程式______。
(5)ClO2分别氧化NO和SO2反应速率常数之比与温度关系如图2所示,可推知随温度升高,ClO2氧化NO反应速率_______。
Ⅱ模拟烟气的组成为:0.03%NO、0.1%SO2、6.0%O2、8.0%H2O,在70℃下,当n(C1O2):n(NO)不断增大(其余为氮气)时,SO2和NO的转化率变化如图3所示。
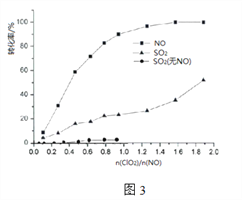
(6)有NO存在时,ClO2氧化SO2______(填“难”、“易”),造成这种情况的可能原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与金刚石的关系是( )
A.同一种物质
B.同分异构体
C.同位素
D.同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )
A.加热
B.不用稀硫酸改用98%的浓硫酸
C.滴加少量硫酸铜溶液
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酸性高锰酸钾溶液褪色的说法正确的是( )
A. 苯的同系物都能使酸性高锰酸钾溶液褪色
B. 2-甲基-3-戊烯可使酸性高锰酸钾溶液褪色
C. 可用酸性高锰酸钾溶液除去乙烷中的乙烯
D. 聚乙炔可以使酸性高锰酸钾溶液和溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在如图所示的装置中用苯(沸点80℃)和液溴制取溴苯(沸点156℃),请根据下列实验步骤回答有关问题。
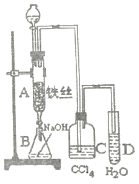
(1)将分液漏斗中的部分苯和溴的混合物加入到A中,则A中发生的化学方程式为______。
(2)反应结束后,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_____。用分液漏斗分离出B中的溴苯时,要想保证上层(有机物层)的纯度,应该进行的操作方法是_____。
(3)反应过程中,被C装置吸收的物质有______;试管D中滴加AgNO3溶液能够观察到的现象为______,此现象证明了A中的反应生成了_______。
(4)为了净化上面实验得到的粗溴苯,可以向粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______。除去溴苯中的少量苯,应该采用的分离操作方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的物质按电解质、非电解质、单质和混合物的顺序排列的一组是( )。
A.HCl、SO3、石墨、液氧B.蔗糖、CuSO4、氮气、CuSO4溶液
C.NaCl、乙醇、铁、空气D.KCl、NaNO3、氯气、石灰水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com