
�о��������������PM2.5�ȴ�����Ⱦ�������������Ҫ���塣
��1����PM2.5����������ˮ�����Ƴɴ�������������ø������г�H+��OH��������ˮ�������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
| ���� | K+ | Na+ | NH4+ | SO42- | NO3�� | Cl�� |
| Ũ��/mol��L-1 | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
 2NO(g��
2NO(g��  H��0
H��0��1��4 (3��)
��2��Ca(HCO3)2��̼�����(2�֣� Ca(HSO3)2 + O2 = CaSO4 + H2SO4(2��)
��3�����¶����ߣ���Ӧ���ʼӿ죬��ƽ��������Ӧ�����ƶ�(2��)
��2CO + 2NO  2CO2 + N2 (2��)
2CO2 + N2 (2��)
��4��191kJ��Q��249.6kJ��4�֣�
���������������1���۲�����з���NH4��ˮ�������ԣ�PM2.5�������Ϊ���ԡ�������pHֵ������Һ�е���غ����H������Ũ��Ϊ10-4��PHֵΪ4��
��2��CO2��CaCO3��Ӧ�������ܵ�Ca(HCO3)2����������ƾ��л�ԭ�ԣ��ɱ�����Ϊ����ƣ���Ӧ�ķ���ʽΪCa(HSO3)2 + O2 = CaSO4 + H2SO4��
��3���������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ�����¶����ߣ���Ӧ���ʼӿ죬ƽ�����ƣ�
������β��ϵͳ��װ�÷�Ӧ�Ļ�ѧ����ʽΪ 2CO + 2NO  2CO2 + N2��
2CO2 + N2��
��4����CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��l����H=��574kJ?mol-1
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H=��1160kJ?mol-1
��H2O��g��=H2O��l����H=��44.0kJ?mol-1
�ɸ�˹���ɢ�+��+�ۡ�2�õ���CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��l������H="-1910" kJ?mol-1��
���Ȼ�ѧ����ʽΪ����CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��l������H=��955 kJ?mol-1��
�ɸ�˹���ɢ�+�ۡ�2�õ�����CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H=��1248kJ?mol-1
��״����4.48LCH4���ʵ���Ϊ0.2mol���ü��������ȫ�����բܣ��ų�����191kJ�����ȫ�����բݣ��ų�����249.6kJ������Q��ȡֵ��Χ��191kJ��Q��249.6kJ��
���㣺���黯ѧ��Ӧԭ���Ļ���֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���û�ѧ��Ӧԭ���о�NH3�����ʾ�����Ҫ���塣��ش��������⣺
��1���������������Թ���ȼ�ϵ�أ����ط�Ӧԭ��Ϊ4NH3��3O2=2N2��6H2O����������ҺӦ���� ������ԡ������ԡ����ԡ����������ĵ缫��ӦʽΪ ��
��2��25��ʱ����amol��L��1�İ�ˮ��0.1mol��L��1������������ϡ�
�ٵ���Һ������Ũ�ȹ�ϵ����c(NH4+)>c(Cl-)��ʱ����Ӧ���������Ϊ ��
A������㣮��ˮʣ�� B����ˮ������ǡ����ȫ��Ӧ C���������
�ڵ���Һ��c(NH4+)=c(Cl-)��ʱ���ú���a���Ĵ���ʽ��ʾNH3��H2O�ĵ���ƽ�ⳣ��Kb=______________.
��3����0.5L�����ܱ������У�һ������N2��H2���з�Ӧ��N2(g)��3H2(g) 2NH3(g) ?H=bkJ/mol���仯ѧƽ�ⳣ��K���¶ȵĹ�ϵ���£�
2NH3(g) ?H=bkJ/mol���仯ѧƽ�ⳣ��K���¶ȵĹ�ϵ���£�
| �¶�/�� | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����֪��C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) ��H=��2220.0kJ/mol
H2O(1) ===H2O(g)����H=+44.0kJ/mol
д������ȼ������CO2����̬ˮ���Ȼ�ѧ����ʽ ��
��2������ͼ��ʾ��ʵ��װ���У�EΪһ���õ��۵⻯����Һ��ʪ����ֽ��C��DΪ������ֽ���˵IJ��У�X��Y�ֱ�Ϊֱ����Դ����������A��B�г���AgNO3��Һ������ʢ��AgNO3��Һ��ˮ���У��ٷֱ���벬�缫���жϵ�Դ����S1���պϿ���S2��ֱͨ����һ��ʱ���B�缫�������أ�A��������ɫ���塣��ش��������⣺
�� д��D�缫��Ӧʽ���������������� ��
��д��ˮ���е��AgNO3��Һ�ܷ�Ӧ�����ӷ���ʽ�� ����������2.16 g���������Ϸų��������ڱ�״���µ������____ _L��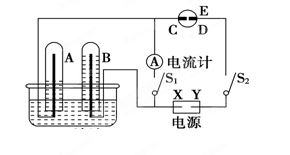
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Դ�����Ⱦ��SO2��NOx�����о�������Ҫ�������塣��ش��������⣺
��1��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�ǽ�úת��Ϊ�������ȼ�ϡ�
��֪��H2��g���� O2��g����H2 O��g�� ��H����241.8kJ��mol��1
O2��g����H2 O��g�� ��H����241.8kJ��mol��1
C��s���� O2��g����CO��g�� ��H����110.5kJ��mol��1
O2��g����CO��g�� ��H����110.5kJ��mol��1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ�� ��
��2����֪����������NO�ķ�ӦΪ��N2��g����O2��g�� 2NO��g�� ��H
2NO��g�� ��H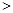 0����1.0 mol������0.80 mol N2��0.20 mol O2��1300oCʱ��1.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ8.0��10��4 mol��
0����1.0 mol������0.80 mol N2��0.20 mol O2��1300oCʱ��1.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ8.0��10��4 mol��
��5s�ڸ÷�Ӧ��ƽ�����ʦͣ�NO�� �� ������2λ��Ч���֣�����1300oC ʱ���÷�Ӧ��ƽ
�ⳣ������ʽK�� ��
�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ���� ��
��3������β����NO��CO��ת��������������һ��ʱ�������������ı���������ѧ��Ӧ���ʡ���ͼ��ʾ��������������ʱ����Ӧ2NO��g����2CO��g�� 2CO2��g����N2��g�� �У�NO��Ũ��
2CO2��g����N2��g�� �У�NO��Ũ��
c��NO�����¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߡ�
�ٸ÷�Ӧ�ġ�H 0 ���������������
���������ı����S1��S2������ͼ�л���c��NO�� ��T1��S2�����´ﵽƽ������еı仯���ߣ�������Ӧ��ע����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���״�ȼ�ϵ�أ�DNFC������Ϊ��21���͵綯������Ѻ�ѡ����Դ��
��1��25�桢101 kPaʱ��1 mol CH3OH��ȫȼ�������ȶ���������ų�����726.51 kJ/mol����״�ȼ�յ��Ȼ�ѧ����ʽΪ:�������� �� ��
��2���״�ȼ�ϵ�صĽṹʾ��ͼ���¡��״����� �����������������д���ü��ĵ缫��Ӧʽ ��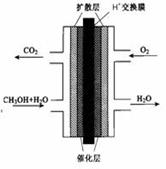
����Ǧ�����ǵ��͵Ŀɳ��͵�أ����������������Ƕ��Բ��ϣ�����ܷ�ӦʽΪ��Pb��PbO2��4H����2SO42�� 2PbSO4��2H2O����ش��������⣨�������⡢����������ԭ����
2PbSO4��2H2O����ش��������⣨�������⡢����������ԭ����
��1���ŵ�ʱ�������ĵ缫��Ӧʽ�� ���Һ��H2SO4��Ũ�Ƚ��������� ��
��2������ȫ�ŵ�ľ�PbO2��Pbʱ��������ͼ���ӣ����һ��ʱ�������A�缫��������������B�缫������������ ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
I����֪����Ӧ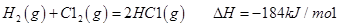
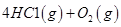
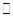
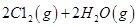

��ش�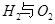 ��Ӧ������̬ˮ���Ȼ�ѧ����ʽ__________________________
��Ӧ������̬ˮ���Ȼ�ѧ����ʽ__________________________
II��ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ����ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ��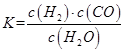
������Ӧ�Ļ�ѧ����ʽΪ��_________________________________________________
��2����֪��400��ʱ����Ӧ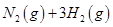
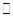
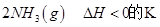 =0��5����400��ʱ����0��5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧ
=0��5����400��ʱ����0��5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧ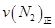 ____________
____________ �������������������ȷ������
�������������������ȷ������
��ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������������ӣ�
�ɲ�ȡ����ȷ��ʩ��____________������ţ�
A���Ӵ��� B�������¶� C����С�������ѹǿ D��ʹ����Һ������
��3����һ��������ܱ������У��������»�ѧ��Ӧ��
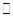
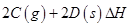 ���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
������������⣺
���жϸ÷�Ӧ��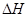 ___________0�������������
___________0�������������
����һ�������£����жϸ÷�Ӧһ���ﻯѧƽ��״̬����___________������ţ���
A�� B��������ѹǿ���ֲ���
B��������ѹǿ���ֲ���
C��A��B��ת������� D�����������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
SNCR��SCR��һ�����͵�������������(��ȥ�����е�NOx�������������£� 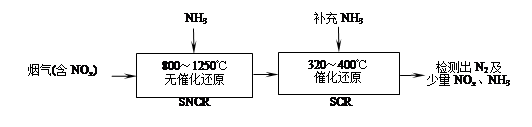
��1����Ӧ2NO��2CO 2CO2��N2�ܹ��Է����У���÷�Ӧ�Ħ�H 0���������������
2CO2��N2�ܹ��Է����У���÷�Ӧ�Ħ�H 0���������������
��2��SNCR��SCR�����з�������Ҫ��Ӧ�У�
��4NO(g)��4NH3(g)��O2(g) 4N2(g)��6H2O(g) ��H����1627.2kJ?mol��1��
4N2(g)��6H2O(g) ��H����1627.2kJ?mol��1��
��6NO(g)��4NH3(g) 5N2(g)��6H2O(g) ��H����1807.0 kJ?mol��1��
5N2(g)��6H2O(g) ��H����1807.0 kJ?mol��1��
��6NO2(g)��8NH3(g) 7N2(g)��12H2O(g) ��H����2659.9 kJ?mol��1��
7N2(g)��12H2O(g) ��H����2659.9 kJ?mol��1��
��ӦN2(g)��O2(g) 2NO(g)�Ħ�H�� kJ?mol��1��
2NO(g)�Ħ�H�� kJ?mol��1��
��3��NO2��O2������NaNO3������ȼ�ϵ�أ���ԭ����ͼ��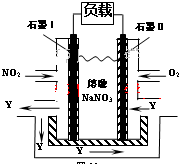
�õ����ʹ�ù�����ʯīI�缫������������Y����缫��ӦΪ��
��4�������øõ�ش�����ҵ��ˮ�к��е�Cr2O72����������������Fe��������⺬Cr2O72-�����Է�ˮ�����ŵ��Ľ��У�����������ҺpH���ߣ�����Cr��OH��3��������ȥCr2O72-��
��д����������Cr2O72������ԭΪCr3+�����ӷ���ʽ�� ��
�ڸõ�ع���ʱÿ����100L Cr2O72-Ũ��Ϊ0.002mol/L��ˮ�����ı�״�������� L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
2SO2��g��+ O2��g�� 2SO3��g�� ��H =" a" kJ·mol��1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99 kJ����ش�
2SO3��g�� ��H =" a" kJ·mol��1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99 kJ����ش�
��1��ͼ��A���ʾ_______________________��a="__________" ��
��2�� Ea�Ĵ�С�Ը÷�Ӧ�ġ�H _______����С� ���ޡ���Ӱ�졣�÷�Ӧ����V2O5������������V2O5��ʹͼ��B��_________������ߡ��������͡����䡱����
��3����֪������ı�ȼ����Ϊ296kJ·mol��1��д����Ӧ���Ȼ�ѧ����ʽ��________________________ ____�����³�ѹ�£��ɵ������������������Ӧ��������1mol SO3��g�����ų���������Ϊ___ ___ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com