
【题目】一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量为14.4 g,若其中水的质量为7.2 g,则CO的质量是 ( )。
A. 2.8 gB. 4.4 gC. 5.6 gD. 在2.8 g~5.6 g之间
科目:高中化学 来源: 题型:
【题目】几种主族元素在周期表中的位置如下
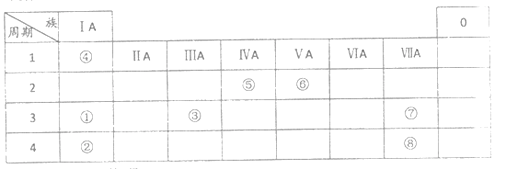
根据上表回答下列问题:
(1)⑥元素的氢化物是_________ (填化学式)
(2)①③⑦三种元素原子半径由大到小的顺序是_________(填元素符号)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_________,该元素在周期表中的位置是__________________。
(4)①②③三种元素氧化物对应水化物碱性最强的是_________(填化学式),①与水反应的化学方程式为_________。
(5)⑦非金属性强于⑧,从原子结构的角度解释其原因:_________。下列表述中能证明这一事实的是_________ (填序号)
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物的水化物的酸性强于⑧最高价氧化物的水化物的酸性
c.⑦能将⑧从其钠盐溶液中置换出来
(6)④与⑤元素形成的分子可能是_________ (填字母序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池的说法不正确的是( )
A.是一种将化学能转换成电能的装置B.较活泼的金属做电池的负极
C.电池负极发生氧化反应D.溶液中阴离子移向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变时,能使反应速率加快的是 ( )
A. 对于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,增大体系的压强
B. 对于反应N2(g)+3H2(g)![]() 2NH3(g),容器体积固定不变时,充入N2
2NH3(g),容器体积固定不变时,充入N2
C. 对于反应N2(g)+3H2(g)![]() 2NH3(g),容器体积固定不变时,充入Ar
2NH3(g),容器体积固定不变时,充入Ar
D. 对于反应N2(g)+3H2(g)![]() 2NH3(g),容器气体压强不变时,充入Ar
2NH3(g),容器气体压强不变时,充入Ar
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李克强总理在《2018年国务院政府工作报告》中强调“今年二氧化硫、氮氧化物排放量要下降3%。”研究烟气的脱硝(除NOx)、脱硫(除SO2)有着积极的环保意义。
Ⅰ. 汽车排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
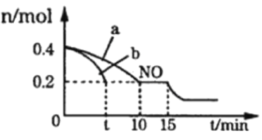
(1)图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)
(2)在a曲线所示反应中,0~10min内,CO的平均反应速率v(CO)=___________;T℃时,该反应的化学平衡常数K=_____________;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_________移动(填“向左”、“向右”或“不”)
(3)15min时, n (NO)发生图中所示变化,则改变的条件可能是_______(填序号)
A.充入少量CO B.将N2液化移出体系 C.升高温度 D.加入催化剂
Ⅱ. 已知有下列反应:
①5O2(g)+ 4NH3(g)![]() 6H2O(g)+ 4NO(g) △H1
6H2O(g)+ 4NO(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③2NO(g)+ O2(g)![]() 2NO2(g) △H3
2NO2(g) △H3
(1)若在高效催化剂作用下可发生8NH3(g)+ 6NO2(g)![]() 7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
(2)某温度下,向某恒容密闭容器中充入一定量的NH3和NO2,按照(1)的原理模拟污染物的处理。若容器中观察到________________(填序号),可判断该反应达到平衡状态
A.混合气体颜色不再改变 B. 混合气体的密度不再改变
C.混合气体摩尔质量不再改变 D. NH3和NO2的物质的量之比不再改变
(3)将一定比例的O2、NH3和NO2的混合气体,匀速通入图(a)所示装有催化剂M的反应器中充分进行反应。
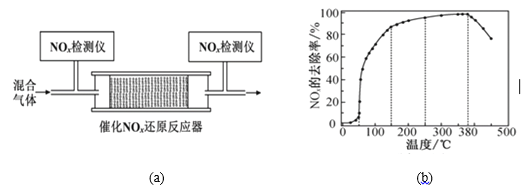
反应相同时间NOx的去除率随反应温度的变化曲线如图(b)所示。已知该催化剂在100~150℃时活性最高,那么在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢,其中去除率迅速上升段的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】齐墩果酸临床用于治疗传染性急性黄疸型肝炎,其结构简式如图所示,下列说法不正确的是

A. 齐墩果酸能使酸性KMnO4溶液褪色 B. 齐墩果酸能和NaHCO3溶液反应产生气体
C. 齐墩果酸分子间能形成酯 D. 齐墩果酸能发生加成反应、取代反应、水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是

A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25℃时,H2CO3的一级电离平衡常数Ka1= 10-6
C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1%
D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容积的容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是
A. SO2为0.4 molL-1,O2为0.2 molL-1 B. SO2为0.25 molL-1
C. SO2、SO3均为0.15 molL-1 D. SO3为0.4 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知石墨和金刚石燃烧化学方程式如下:
C(石墨,s)+O2(g)==CO2(g)
C(金刚石,s)+O2(g)==CO2(g)
质量分别为12 g的石墨和金刚石在某一相同条件下燃烧时放出的热量分别为393.8 kJ和395.2 kJ,问:对于单质来说,稳定的单质是石墨还是金刚石?简述理由。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com