
【题目】下列物质属于纯净物的是
A. 生铁 B. 水玻璃 C. 冰水混合物 D. 漂白粉
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】将物质的量均为a mol的Na和Al一同投入m g足量水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1 C.
mol·L-1 C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,反应前与反应后相比较,肯定不变的是( )
①元素的种类 ②原子的种类 ③分子的数目 ④原子的数目 ⑤反应前物质的质量总和与反应后物质的质量总和 ⑥如果在水溶液中反应,反应前与反应后阳离子所带的正电荷总数
A. ①②③④ B. ①②⑤⑥ C. ①②④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙两实验小组同学对铁及其化合物的性质进行如下探究:
I.甲组同学利用如图装置探究过量铁粉与浓H2SO4反应产生的气体成分。

(1)组装好实验仪器后,接下来的实验操作是____________________;
(2)B中观察到品红溶液褪色,D中收集到VmL水,说明A中反应产生气体的成分
是______________________。
II.乙组同学对反应后圆底烧瓶溶液中所含金属离子进行探究。
(3)铁与浓H2SO4的反应过程中必有Fe3+生成。取适量反应后的溶液,加入少量KSCN溶液,不变红色。原因是_______________(用离子方程式表示)。
(4)取适量反应后的溶液,加人少量酸性高锰酸钾溶液,溶液褪色。该反应原理的离子方程式为 _______________________。
(5)取少量反应后的溶液,先滴加少量新制氯水,再滴加KSCN溶液,呈现血红色,继续滴加过量新制氯水,红色褪去。
①分析其可能的原因是:
A.溶液中Fe3+被氧化成更髙价;
B.____________________________;
C.______________________。
②请选用下列合适的化学试剂,验证结论A是否正确。0.lmol/L FeCl3溶液、lmol/L FeCl2溶液、KSCN溶液、新制氯水、一定浓度的H2O2溶液。
操作、现象及相关结论为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活和生产中常用到胶体的性质,请看下述四例:
(1)做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是 。
(2)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量。解决方法之一是把这些陶土和水一起搅拌,使微粒直径在10-9~10-7 m之间,然后插入两根电极,再接通直流电源。这时阳极聚集陶土胶粒,阴极聚集氧化铁胶粒,理由是 。
(3)实验室里制取氢氧化铁胶体利用了水解原理,用氯化铁制取氢氧化铁胶体的化学反应方程式为:____________,制备时将饱和的FeCl3溶液滴入沸水中,选用沸水的原因是:____________。
(4)四氧化三铁在强碱性溶液中与次氯酸盐反应,生成高铁酸盐(![]() ),
),![]() 有强氧化性,可以杀菌消毒。高铁酸盐还有净化水的作用,能净化水的原因是 。
有强氧化性,可以杀菌消毒。高铁酸盐还有净化水的作用,能净化水的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.升高温度,K减小 B.减小压强,n(CO2)增加
C.更换高效催化剂,α(CO)增大 D.充入一定量的氮气,n(H2)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、H2、CH3、OH均是清洁能源。
(1)已知部分化学键键能数据如下:
化学键 | C | O=O | C=O | C-O |
E/(kJ mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g) △H1
H2O(g)+CO(g)==H2(g) + CO2(g) △H2 = -41 kJmol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) △H3 = -660kJmol-1
则△H1=_____ kJmol-1,反应CO(g)+2H2(g) ![]() CH3OH(g)的△H=_____ kJmol-1。
CH3OH(g)的△H=_____ kJmol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
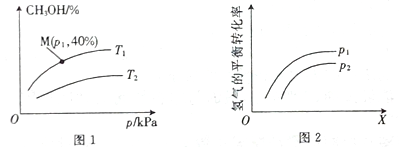
①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②p1_____p2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为p1、温度为T1时该反应的平衡常数K=______________。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(3)甲醇燃料电池是一种具有高能量转化率的绿色电池,则用磷酸溶液作电解质时,负极的电极反应式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com