
【题目】某一元醇的化学式为C6H14O,已知其分子中有二个—CH3、三个—CH2—、一个![]() ,此一元醇可能的结构有
,此一元醇可能的结构有
A. 4种 B. 5种 C. 6种 D. 7种
【答案】C
【解析】
己烷的同分异构体有:CH3(CH2)4CH3;CH3CH2CH2CH(CH3)2;CH3CH2CH(CH3)CH2CH3;CH3CH2C(CH3)3;CH3CH(CH3)CH(CH3)CH3。若为CH3(CH2)4CH3,饱和一元醇有:CH3CH2CH2CH2CH2CH2OH;CH3CH2CH2CH2CHOHCH3;CH3CH2CH2CHOHCH2CH3;其中CH3CH2CH2CH2CHOHCH3;CH3CH2CH2CHOHCH2CH3符合条件。若为CH3CH2CH2CH(CH3)2,饱和一元醇有:HOCH2CH2CH2CH(CH3)2;CH3CHOHCH2CH(CH3)2;CH3CH2CHOHCH(CH3)2;CH2OHCH(CH3)CH2CH3;其中HOCH2CH2CH2CH(CH3)2符合条件。若为CH3CH2CH(CH3)CH2CH3,饱和一元醇有:HOCH2CH2CH(CH3)CH2CH3;CH3CHOHCH(CH3)CH2CH3;CH3CH2CH(CH2OH)CH2CH3;CH3CH2CH(CH3)CH2CH2OH,其中HOCH2CH2CH(CH3)CH2CH3;CH3CH2CH(CH2OH)CH2CH3;CH3CH2CH(CH3)CH2CH2OH符合条件。若为CH3CH2C(CH3)3,饱和一元醇有:HOCH2CH2C(CH3)3;CH3CHOHC(CH3)3;CH3CH2C(CH3)2CH2OH,均不符合条件。若为CH3CH(CH3)CH(CH3)CH3,饱和一元醇有:CH2OHCH(CH3)CH(CH3)CH3;CH3COH(CH3)CH(CH3)CH3;CH3CH(CH2OH)CH(CH3)CH3,均不符合条件。故符合条件有6种。故选C。


科目:高中化学 来源: 题型:
【题目】大功率镍氢动力电池及其管理模块,是国家“十五”863计划电动汽车专项中一项重要课题。我国镍氢电池居世界先进水平,解放军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零)。电池反应通常表示为LaNi5H6+6NiO(OH) ![]() LaNi5+6Ni(OH)2。关于镍氢电池放电时的下列说法中不正确的是( )
LaNi5+6Ni(OH)2。关于镍氢电池放电时的下列说法中不正确的是( )
A. 储氢合金作负极
B. 正极反应式:6NiO(OH)+6H2O+6e-=6Ni(OH)2+6OH-
C. 负极反应式:LaNi5H6+6OH--6e-=LaNi5+6H2O
D. 电子由正极通过外电路流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1999年合成了一种新化合物,用X为代号。用现代物理方法测得X的相对分子质量为64;X含碳93.8%,含氢6.2%;X分子中有3种化学环境不同的氢原子和4种化学环境不同的碳原子;X分子中同时存在C—C、C=C、C≡C三种键,并发现其C=C键比寻常的C=C键短。
(1)X的分子式是_______。
(2)请写出X可能的结构简式____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜-锌原电池如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法不正确的是
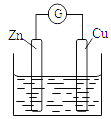
A. 锌电极上的反应为Zn-2e-=Zn2+
B. 电子从锌电极经过硫酸铜溶液流向铜电极
C. 溶液中的SO42-向锌电极移动
D. 铜电极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选做-选修3:物质结构与性质】硒化锌是一种半导体材料,回答下列问题。
(1)锌在周期表中的位置_______;Se基态原子价电子排布图为______。元素锌、硫和硒第一电离能较大的是________(填元素符号)。
(2)Na2SeO3分子中Se原子的杂化类型为_______;H2SeO4的酸性比H2SeO3强,原因是_______。
(3)气态SeO3分子的立体构型为_______;下列与SeO3互为等电子体的有__(填序号)。
A.CO32- B.NO3- C.NCl3 D.SO32-
(4)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为______(填元素符号);该晶胞中硒原子所处空隙类型为_____(填“立方体”、“正四面体”或正八面体”);若该品晶胞密度为ρg/cm3,硒化锌的摩尔质量为Mg/mol。用NA代表阿伏加德罗常数的数值,则晶胞参数a为_______nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质性质如下:
甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
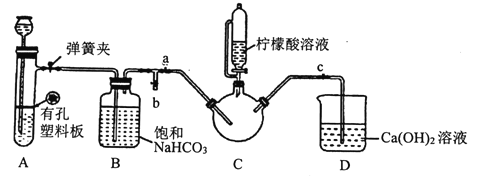
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为____(写化学式)。
(2)实验II中:生成沉淀的离子方程式为________________。
(3)实验III中:
①检查装置A的气密性的方法是_________。
②装置A中所盛放的药品是_______ (填序号)。
a.Na2CO3和稀H2SO4 b.CaCO3和稀H2SO4 c.CaCO3和稀盐酸
③确认c中空气排尽的实验现象是______________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是_______。
⑤洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是___(填序号)。
a.热水 b.乙醇溶液 c.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室硫酸试剂标签上的部分内容,据此下列说法正确的是( )

A. 配制稀硫酸定容时俯视刻度线会造成所配溶液浓度偏高
B. 取该硫酸1ml与1ml水混合后,物质的量浓度为9.2mol/L
C. 将该硫酸配成1mol/L的稀硫酸480ml所需的玻璃仪器只有:烧杯、500ml容量瓶、玻璃棒
D. 1molFe与足量的该硫酸反应产生1mol氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)已知:Fe3O4(s) + CO(g)=3FeO(s) + CO2(g)ΔH1= +19.3 kJ·mol-1
3FeO(s) + H2O(g)=Fe3O4(s) + H2(g)ΔH2= -57.2 kJ·mol-1
C(s) + CO2(g)=2 CO(g)ΔH3= +172.4 kJ·mol-1
写出以铁氧化物为催化剂裂解水制氢气总反应的热化学方程式___________。
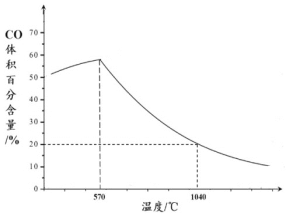
(2)下图表示其它条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
①当温度低于570℃时,温度降低,CO的转化率__________(填“增大”、“减小”或“不变”),理由是_______________。
②当温度高于570℃时,随温度升高,反应Fe3O4(s) + CO(g)![]() 3FeO(s) + CO2(g)平衡常数的变化趋势是_________;(填“增大”、“减小”或“不变”);1040℃时,该反应的化学平衡常数的数值是____________。
3FeO(s) + CO2(g)平衡常数的变化趋势是_________;(填“增大”、“减小”或“不变”);1040℃时,该反应的化学平衡常数的数值是____________。
II、汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
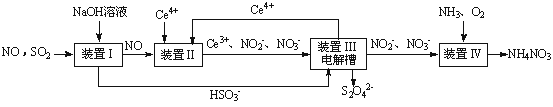
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成NO3-和NO2-物质的量之比为2:1时的离子方程式:________________________。
(2)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为_________。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1.5 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数,否则不给分)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属钛的推断不正确的是( )
A.钛的原子序数为22
B.钛位于元素周期表第四周期
C.钛原子核外电子排布式为1s22s22p63s23p63d4
D.钛属于过渡元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com