
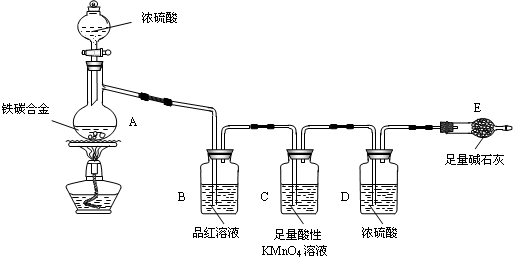
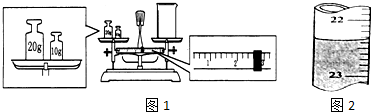
分析 由实验装置图1可知,装置A中浓硫酸和铁、碳在加热的条件下反应生成了二氧化碳和二氧化硫,装置B品红溶液是检验二氧化硫气体的,装置C足量的高锰酸钾溶液是除掉二氧化硫的,装置D是用于干燥二氧化碳气体,最后得到干燥的二氧化碳被实验装置E中足量的碱石灰吸收.
(1)依据装置中的压强变化恒容液面变化分析检验,最后导气管插入水,加热发生装置导气管冒气泡,停止加热上升一段水柱;
(2)根据ag铁碳合金,加入过量浓硫酸,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则可求出ag铁碳合金中含碳元素的质量进而求出铁的质量分数;
(3)装置C是利用高锰酸钾的强氧化性吸收二氧化硫气体;
(4)空气中CO2、H2O进入E管使b增大,则求出的二氧化碳的质量偏大;
(5)E装置后再连接一个盛碱石灰的干燥管防止空气中的二氧化碳、水蒸气进入干燥管;装置中生成的二氧化碳不能全部被碱石灰吸收;
(6)常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应;
(7)铁和过量浓硫酸加热反应生成硫酸铁、二氧化硫和水,浓硫酸作用依据化学方程式中化合价变化分析作用.
解答 解:在装置A中发生Fe和C与浓硫酸的反应,产生CO2、SO2和铁的氧化物,装置B检验SO2,装置C吸收SO2,装置D干燥气体的,装置E是吸收CO2的,E增重的质量b是CO2的质量.
(1)关闭分液漏斗的活塞,在E装置后面连上一根导管,然后把导管放入盛有水的水槽中,微热烧瓶,如果导管口有气泡产生,停止加热后导管产生一段水柱,
故答案为:把导管放入盛有水的水槽中,微热烧瓶,如果导管口有气泡产生,停止加热后导管产生一段水柱;
(2)称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量为$\frac{12b}{44}$g=$\frac{3b}{11}$g,则含铁的质量为ag-$\frac{3b}{11}$g,铁的质量分数为$\frac{11a-3b}{11a}$×100%,
故答案为:$\frac{11a-3b}{11a}$×100%;
(3)装置C是利用高锰酸钾溶液的强氧化性吸收二氧化硫,5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,所以装置C的作用是除去CO2中的SO2,
故答案为:除去CO2中的SO2;
(4)空气中CO2、H2O进入E管使b增大,则求出的二氧化碳的质量偏大,即碳的质量偏大,所以铁的质量偏小,铁的质量分数偏小;
故答案为:空气中CO2、H2O进入E管使b增大;
(5)E中所装试剂为碱石灰,可吸收空气中CO2、H2O使b增大,改进的方法是增加一个盛碱石灰的干燥管防止空气中的二氧化碳和水进入;装置中生成的二氧化碳不能全部被碱石灰吸收会导致b偏低,
故答案为:空气中CO2、H2O进入E管使b增大;反应产生的CO2气体未能完全排到装置E中,导致b偏低;
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应,
故答案为:常温下,Fe被浓H2SO4钝化,碳不与浓H2SO4反应;
(7)铁和过量浓硫酸加热反应生成硫酸铁、二氧化硫和水,反应的化学方程式为:2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O,
故答案为:2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O.
点评 本题考查了有关浓硫酸、铁、碳等物质性质的探究实验,侧重考查了实验方法、装置的特征分析,流程反应和试剂作用是解题关键,题目难度中等.


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g氧气和臭氧的混合物含有的原子数为NA | |
| B. | 39 g Na2O2含有2 NA个离子 | |
| C. | 标准状况下,22.4 L 乙醇所含分子数为NA | |
| D. | 18 g D2O含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Na2SO4 | C. | Na2CO3 | D. | NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
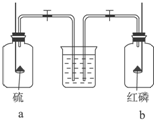
| A. | 水先进入a瓶 | B. | 水先进入b瓶 | ||
| C. | 水同时进入两瓶 | D. | 水不进入任何一瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.5×10-3 g | B. | 7×10-4 g | C. | 4.52×10-3 g | D. | 4.52×10-2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
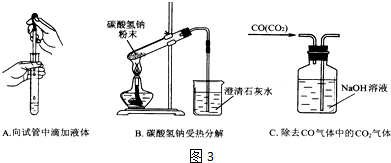
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
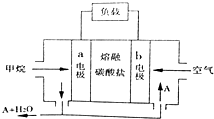
| A. | 正极的电极反应为:O2+2H2O+4e-=4OH- | |
| B. | 电池工作时,CO32-移向b电极 | |
| C. | 若实验过程中转移4mol电子,则该电池消耗11.2L CH4 | |
| D. | 为使电池稳定运行,电池的电解质组成应保持恒定.该电池工作时,应有物质A循环利用,A为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若烃中碳、氢元素的质量分数相同,则为同系物 | |
| B. | CH2═CH2和CH2═CH-CH═CH2互为同系物 | |
| C. | 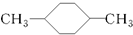 和 和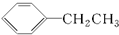 互为同分异构体 互为同分异构体 | |
| D. | 同分异构体的化学性质可能相似 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com