
【题目】(1)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
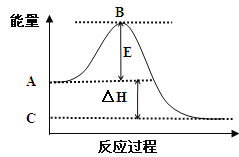 请回答下列问题:
请回答下列问题:
①图中A点表示:
C点表示:
E的大小对该反应的反应热 (填“有”或“无”)影响。
②图中△H= kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
【答案】(1)①反应物的总能量;生成物的总能量;无;-198
(2)①H2 (g) +![]() O2 (g)=H2O ( g ) ΔH =―241.8 kJ/mol ;―286.8 ;―286.8
O2 (g)=H2O ( g ) ΔH =―241.8 kJ/mol ;―286.8 ;―286.8
【解析】(1)①根据图像可知,反应物总能量高于生成物总能量,所以该反应为放热反应,由此可知图中A点表示反应物的总能量;C点表示生成物的总能量;E表示活化能,活化能的大小对该反应的反应热无影响。
②图中表示的是2molSO2的反应,因此△H=-99×2="-198" kJ·mol-1;
(2)①氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量,则反应的热化学方程式
为H2 (g)+![]() O2 ( g )=H2O(g) ΔH =―241.8 kJ/mol;
O2 ( g )=H2O(g) ΔH =―241.8 kJ/mol;
②根据①H2 (g) +![]() O2 (g)=H2O(g) ΔH =―241.8 kJ/mol;②H2O(g)=H2O(l)
O2 (g)=H2O(g) ΔH =―241.8 kJ/mol;②H2O(g)=H2O(l)
△H= —45kJ/mol。氢气燃烧生成气态水时放出热量为241.8KJ,气态水生成液态水放出热量为45KJ,故氢气的燃烧热为286.8KJ。


科目:高中化学 来源: 题型:
【题目】下列叙述不能体现相关主旨的是
A. “水域蓝天,拒绝污染”一严控PM 2.5排放,改善雾霾天气
B. “化学,让生活更美好”一积极开发风力发电,让能源更清洁
C. “节能减排,低碳经济”一综合利用煤和石油,发展绿色化学
D. “化学,引领科技进步”一研究合成光纤技术,让通讯更快捷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成路线如图所示。
![]()
(1)已知AlCl3的熔点为190℃,沸点为178℃,在湖湿的空气中易水解。某实验小组利用下图中装置制备无水AlCl3。
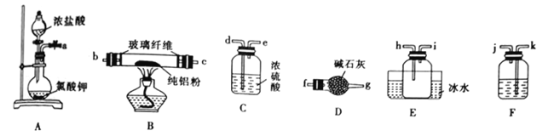
①写出圆底烧瓶中发生反应的离子方程式:_________________。
②按气流方向连接各仪器接口,顺序为a→__________b→c→_______。 (填接口字母)
③装置F中应盛装的试剂是__________,装置D的作用是______________。
(2)AlCl3与NaH反应时,需先将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末中,此反应中NaH的转化率较低,其原因可能是______________。
(3)通过测定铝氢化钠与水反应生成氢气的体积来测定铝氢化钠样品的纯度。
①铝氢化的与水反应的化学方程式为______________。
②设计如下四种装置测定铝氢化钠样品的纯度(杂质只有氢化钠)。从简约性、准确性考虑,最恰当的装置是___(填编号)。
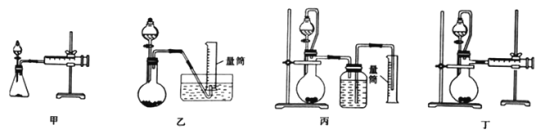
③某同学选用上述最恰当的裴置,称取mg铝氢化钠样品,测得生成气体的体积为VL(已折算为标准状况),重复实验操作三次,测得有关数据如下表所示,则样品中铝氢化钠的纯度为____。
实验次数 | 样品质量m(g) | 气体休积V(L) |
I | 1.20 | 1.907 |
II | 1.20 | 1.904 |
III | 1.20 | 1,901 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.向血红色的Fe(SCN)3溶液中加入少量KI 固体,溶液颜色变浅
B.氨水溶液加水稀释,c(OH-)增大,平衡常数增大
C.pH=12的NaOH和Na2S溶液中水的电离程度前者大于后者
D.25℃,Cu(OH)2在水中的溶度积和溶解度比其在Cu(NO3)2溶液中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. SO2和SO3互为同分异构体
B. 液溴和溴蒸气是同素异形体
C. 金刚石和石墨都是由碳原子构成,因此它们是同种物质
D. 乙醇和二甲醚互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐的组成可表示为3[H3ON5]:3[NH4N3]·NH4Cl。回答下列问题
(1)氯原子的电子排布式为________________________.
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_____________;氮元素的E1呈现异常的原因是_____________。
(3)经X射线衍射测得化合物3[H3ON5]·3NH4N5]·NH4Cl的晶体结构,其局部结构如图(b)所示
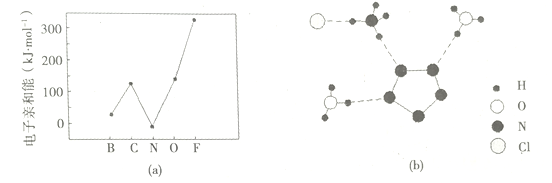
①H3O+中心原子的杂化类型为___________,NH4+的空间构型为_________。
②3[H3ON5]·3[NH4N5]·NH4C1中阴离子N5-中的![]() 键总数为______个。分子中的大
键总数为______个。分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大键的原子数,n代表参与形成大键的电子数(如苯分子中的大
表示,其中m代表参与形成大键的原子数,n代表参与形成大键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则N5-中的大
),则N5-中的大![]() 键应表示为____________________。
键应表示为____________________。
③图(b)中虚线代表氢键,其中表示式为(NH4)N一H……Cl、_______、______。
(4)3[H3ON5]·3[NH4N5]·NH4Cl的晶体密度为dg.cm-3,其立方晶胞参数为a nm,晶胞中含有y个3[H3ON5]·3[NH4N5]·NH4Cl单元,该单元的相对质量为M,则y的计算表达式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法正确的是( )
A. 聚乙烯、聚氯乙烯、纤维素都是合成高分子化合物
B. 天然油脂的分子中含有酯基,属于酯类物质
C. 可以用加热的方法分离提纯蛋白质
D. 乙醇、乙酸、乙烯都能发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com