
| A. | 常温下,浓硫酸能使铝钝化,可用铝制容器贮运浓硫酸 | |
| B. | 二氧化硅熔点很高、硬度很大,可用于制造坩埚 | |
| C. | 氯化铁溶液能腐蚀铜,可用于制作印刷电路板 | |
| D. | 金属钠硬度小、密度小,可用于制造高压钠灯 |
分析 A.浓硫酸具有强的氧化性,常温下与铝发生钝化,形成致密氧化膜;
B.二氧化硅为原子晶体,熔点高;
C.氯化铁具有氧化性,能够与铜发生氧化还原反应;
D.钠的焰色为黄色,透雾性强.
解答 解:A.浓硫酸具有强的氧化性,常温下与铝发生钝化,形成致密氧化膜,阻止反应进行,所以可用铝制容器贮运浓硫酸,故A正确;
B.二氧化硅为原子晶体,熔点高,耐高温,可以制作坩埚,故B正确;
C.氯化铁具有氧化性,能够与铜发生氧化还原反应生成氯化铜和氯化亚铁,故C正确;
D.钠可用于制造高压钠灯,高压钠灯射程很远,与钠的硬度和密度无关,故D错误;
故选:D.
点评 本题考查了物质的用途,熟悉浓硫酸、二氧化硅、氯化铁、钠的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有2对 | |
| B. | 某元素能形成+7价的含氧酸及其盐,则该元素一定为主族元素 | |
| C. | L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| D. | 同主族两种短周期元素原子序数之差不可能是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
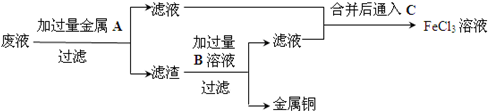
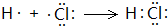 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )| A. | 与金属钠作用时,键①断 | |
| B. | 浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在银催化下和氧气反应时,键①和④断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑥ | C. | ②④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com