
下列关于2042Ca2+的叙述中,正确的是( )
A.质子数为22 B.电子数为20 C. 中子数为18 D.质量数为:42
科目:高中化学 来源:2013-2014河北省保定市、定兴三中高二下学期期末化学试卷(解析版) 题型:选择题
某有机物的结构简式如图所示,下列说法不正确的是
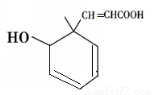
A.分子式为C10H12O3
B.含有3种官能团
C.1 mol该分子中含有3 mol双键
D.既可以发生取代反应又可以发生加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高二化学试卷(解析版) 题型:选择题
有下列几种反应类型:①消去②加聚③水解④加成⑤还原⑥氧化,用丙醛制取1,2一丙二醇,按正确的合成路线依次发生的反应所属类型应是 ( ) 
A.⑤①④③ B.⑥④③① C.①②③⑤ ` D.⑤③④①
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
按下图的装置进行试验,若图中X轴表示阴极的电子的量 ,则Y轴可能表示为( )
,则Y轴可能表示为( )
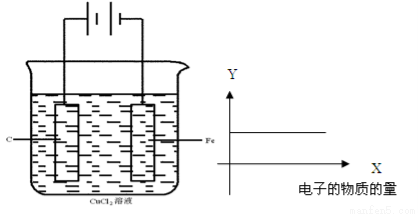
A. Cu2+物质的量浓度 B.C棒的质量
C.Fe棒的质量 D.Cl-物质的量浓度
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列关于化学反应与能量的说法正确的是( )
A.化学反应中一定有物质变化,但不一定有能量变化
B.CaO+H2O =Ca(OH)2是放热反应,说明CaO 的能量大于Ca(OH)2的能量
C.Ba(OH)2·8H2O晶体与氯化铵 晶体反应不需加热就能发生,说明该反应是放热反应
晶体反应不需加热就能发生,说明该反应是放热反应
D.由H2→2H的过程需要吸收能量
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
最近科学家发现了氧元素的一种新的粒子O4,对于这种新粒子,下列说法不正确的是( )
A.它是氧气的一种同素异形体 B.它是氧元素的一种同位素
C.它的摩尔质量是64 g·mol-1 D.它具有很强的氧化性
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
(16分)氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。 当悬浮物较多时,停止制备。

注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是_________________________________________,液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 | 得到无色溶液 |
步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵。 |
步骤3:向试管中继续加入 。 | ,证明固体中含有碳酸氢铵。 |
②根据①的结论:取氨基甲酸铵样品3.95 g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97 g。则样品中氨基甲酸铵的物质的量分数为_______________。[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(BaCO3)=197]
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+)
C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高三4月联考理综化学试卷(解析版) 题型:选择题
硫-钠原电池具有输出功率较高,循环寿命长等优点。其工作原理可表示为:2Na+xS Na2Sx。但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(
Na2Sx。但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物( )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列有关叙述正确的是
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列有关叙述正确的是
A. 多硫化合物(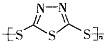 )是一种新型无机非金属材料
)是一种新型无机非金属材料
B. 多硫化合物(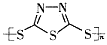 )化合物不能发生加成反应
)化合物不能发生加成反应
C. 原电池的负极反应是将单体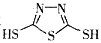 转化为
转化为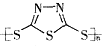 的过程
的过程
D. 当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com