
a mol氨完全氧化成HNO3,并且全部溶于反应生成的水中,得HNO3的质量分数约为
A.78% B.42% C.50% D.63%
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 催化剂 | △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
![]()
已知:
![]() 4NO+3O2+2H2O 4HNO3
4NO+3O2+2H2O 4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80,请完成下列填空及计算:
(1)a mol NO完全转化为HNO3需要氧气 mol。
(2)为使NH3恰好完全氧化为一氧化氮,氨与空气混合物中氨的体积分数为 (保留2位小数)。
(3)20.0 mol的NH3用空气氧化,产生混合物的组成为NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量的硝酸,以及其他成分。(高温下NO和O2不反应)
计算氨转化为NO和HNO3的转化率。
(4)20.0 mol的NH3和一定量空气充分反应后,再转化为HNO3。
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
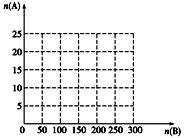
②写出当125≤n(B)≤200时,n(A)和n(B)的关系式 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:计算题
(1)氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
①配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
②若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
已知:4NH3+O2 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3
(2)设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
①a mol NO完全转化为HNO3理论上需要氧气_____________mol。
②为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________
(保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。

查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市青浦区高考一模化学试卷(解析版) 题型:填空题
氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
1、(1)配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
(2)若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
2、已知:4NH3+O2 4NO+6NO,4NO+3O2+2H2O
4NO+6NO,4NO+3O2+2H2O 4HNO3
4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
(1)a mol NO完全转化为HNO3理论上需要氧气_____________mol。
(2)为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________ (保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算
(1)a mol NO完全转化为HNO3需要氧气_______ mol
(2)为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为________(保留2位小数)。
(3)20.0 moL的NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应)计算氨转化为NO和HNO3的转化率。
(4)20.0 moL 的NH3和一定量空气充分反应后,再转化为HNO3
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
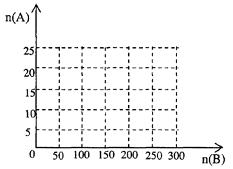
②写出当125≤n(B)≤200时,n(A)和n(B)的关系式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com