(2010?南京二模)黄铁矿的主要成分是FeS
2.测定黄铁矿中FeS
2含量的两种方法如下图所示:
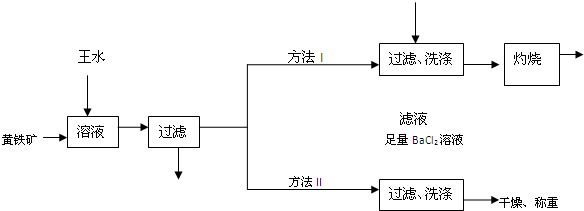
已知:FeS
2+5HNO
3+3HCl=FeCl
3+2H
2SO
4+5NO↑+2H
2O
请回答下列问题:
(1)方法Ⅰ中灼烧滤渣用的仪器除酒精灯、三角架、还有
坩埚、坩埚钳、泥三角
坩埚、坩埚钳、泥三角
.
(2)方法Ⅱ中加足量BaCl
2溶液的作用是
使硫酸根离子完全沉淀
使硫酸根离子完全沉淀
,判断加入BaCl
2溶液已过量的操作是
静置取上层清夜继续加入氯化钡溶液,若无白色沉淀生成说明说明氯化钡过量
静置取上层清夜继续加入氯化钡溶液,若无白色沉淀生成说明说明氯化钡过量
.
(3)用方法Ⅰ测定黄铁矿试样中FeS
2的含量,发现测定结果总是偏高,则产生误差的可能原因是:①
加氨水时形成了其他不溶性杂质
加氨水时形成了其他不溶性杂质
;②
氢氧化铁沉淀表面积大吸附了杂质
氢氧化铁沉淀表面积大吸附了杂质
.(测定过程中由操作产生的误差可忽略.)
(4)称取黄铁矿试样1.60g,用方法Ⅱ进行测定,称得干燥后的滤渣质量为1.66g,假设矿石中的硫元素全部来自于FeS
2,则该矿石中FeS
2的质量分数是
26.7%
26.7%
.




 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案