
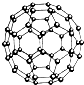
 N60结构如图,28g N60单质中含有的N-N键个数为NA
N60结构如图,28g N60单质中含有的N-N键个数为NA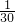 mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供
mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供 个N-N键,所以分子共有N-N数目为60×3×
个N-N键,所以分子共有N-N数目为60×3× =90.
=90.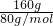 =2mol,转移2NA个电子,即转移电子的物质的量为2mol,根据电子转移守恒可知,铜在还原产物的化合价为+1价,即生成氧化亚铜与氧气,反应方程式为4CuO=2Cu2O+O2↑,故B错误;
=2mol,转移2NA个电子,即转移电子的物质的量为2mol,根据电子转移守恒可知,铜在还原产物的化合价为+1价,即生成氧化亚铜与氧气,反应方程式为4CuO=2Cu2O+O2↑,故B错误;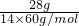 =
=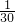 mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供
mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供 个N-N键,所以分子共有N-N数目为60×3×
个N-N键,所以分子共有N-N数目为60×3× =90,含有有的N-N键个数为
=90,含有有的N-N键个数为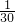 mol×90×NAmol-1=3NA,故C错误;
mol×90×NAmol-1=3NA,故C错误;

 阅读快车系列答案
阅读快车系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com