考点:阿伏加德罗常数,物质分子中的原子个数计算,离子方程式的有关计算,物质的量浓度的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律,物质的量浓度和溶解度专题
分析:(1)根据n=
计算OH
-的物质的量,根据m=nM计算OH
-的质量;
(2)根据n=
=
=
结合物质的构成来计算各物理量;
(3)用等体积、等浓度的溶液恰好可使相同体积的NaCl、AlCl
3、MgCl
2三种溶液中的氯离子完全转化为氯化银沉淀,则所生成的沉淀AgCl的物质的量相同,令AgCl的物质的量为1mol,根据氯原子守恒计算n(NaCl)、n(MgCl
2)、n(AlCl
3),体积相同,浓度之比等于物质的量之比;
(4)根据溶液呈电中性,溶液中阴阳离子所带电荷相等计算氢离子浓度;
(5)根据n=
=
进行相关量的计算;(6)根据n=
计算3.22g芒硝的物质的量,根据芒硝的化学式可知n(Na
+)=2n(Na
2SO
4?10H
2O),每100个水分子中溶有1个Na
+,则n(H
2O)=100n(Na
+),水的总的物质的量减去Na
2SO
4?10H
2O晶体中含有水的物质的量为需要加入的水,再根据m=nM计算需要水的质量.
解答:
解:(1)3.01×10
23个OH
-的物质的量为
=0.5mol,质量为0.5mol×17g/mol=8.5g,
故答案为:0.5mol;8.5g;
(2)n(CH
4)=
=0.3mol,m(CH
4)=0.3mol×16g/mol=4.8g,N(H)=4×0.3mol×N
A/mol=1.2N
A,
②n(HCl)=
=0.5mol,m(HCl)=0.5mol×36.5g/mol=18.25g,N(H)=N(HCl)=0.5N
A;
③m(NH
3)=0.2mol×17g/mol=3.4g,N(H)=3×0.2mol×N
A/mol=0.6N
A;
所以:三种气体按质量由大到小排列的顺序是②>①>③;氢原子数由少到多排列的顺序是②<③<①;根据气体ρ与相对分子质量成正比,可得密度由大到小排列的顺序是②>③>①,
故答案为:②>①>③;②<③<①;②>③>①;
(3)相同体积的NaCl、AlCl
3、MgCl
2三种溶液过量的硝酸银溶液反应,所生成的沉淀AgCl的物质的量相同,令AgCl的物质的量为1mol,根据氯原子守恒,则:
n(NaCl)=n(AgCl)=1mol
n(AlCl
3)=
n(AgCl)=
×1mol=
mol
n(MgCl
2)=
n(AgCl)=
×1mol=
mol
体积相同,浓度之比等于物质的量之比,故c(NaCl):c(AlCl
3):c(MgCl
2)=1mol:
mol:
mol=6:2:3,
故答案为:6:2:3;
(4)溶液呈电中性,溶液中阴阳离子所带电荷相等,所以c(Na
+)+c(NH
4+)+c(H
+)=c(Cl
-)+2c(SO
42- ),
所以2.4×10
-3+2.3×10
-3+c(H
+)=3.5×10
-3+2×4.0×10
-3,c(H
+)=6.8×10
-3mol?L
-1,
故答案为:6.8×10
-3mol?L
-1;
(5)设CO的物质的量为x,CO
2的物质的量为y,则
| | (x+y)×22.4=11.2 | | 28x+44y=18 |
| |
解之得:x=0.25mol,y=0.25mol,
则:V(CO):V(CO
2)=n(CO):n(CO
2)=0.25mol:0.25mol=1:1;
m(CO)=0.25mol×28g/mol=7g,m(CO
2)=0.25mol×44g/mol=11g,
所以:m(CO):m(CO
2)=7:11,
故答案为:1:1;7:11;
(6)3.22g芒硝的物质的量为
=0.01mol
所以溶液中n(Na
+)=2n(Na
2SO
4?10H
2O)=0.01mol×2=0.02mol
每100个水分子中溶有1个钠离子,所以n(H
2O)=100n(Na
+)=2mol
0.01molNa
2SO
4?10H
2O中含有水的物质的量为0.01mol×10=0.1mol
所以需要的水的物质的量为2mol-0.1mol=1.9mol
所以需要水的质量为1.9mol×18g/mol=34.2g,
故答案为:34.2.
点评:本题考查物质的量的相关计算,题目难度一般,但涉及知识点较多,注意有关计算公式的运用.



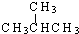 和
和 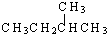 ②
②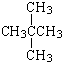 和
和