
 .
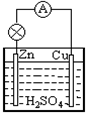
. 分析 根据反应方程式可知,锌作负极 碳或比锌不活泼的金属作正极,稀硫酸为电解质溶液,据此画出原电池装置图,根据原电池的反应原理分析解答.
解答 解:该原电池中,负极材料为金属锌,正极材料可以为铜棒或活泼性比锌若的其它金属材料,电解质溶液为稀硫酸或者稀盐酸,据此画出该原电池装置图为: ,负极是锌,正极是铜,负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+;氢离子在正极得到电子生成氢气,发生得到电子,发生还原反应,电极反应为:2H++2e-═H2↑,故答案为:锌;铜;Zn-2e-═Zn2+;2H++2e-═H2↑;氧化反应;还原反应;
,负极是锌,正极是铜,负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+;氢离子在正极得到电子生成氢气,发生得到电子,发生还原反应,电极反应为:2H++2e-═H2↑,故答案为:锌;铜;Zn-2e-═Zn2+;2H++2e-═H2↑;氧化反应;还原反应; .
.
点评 本题考查了原电池工作原理、原电池装置图的设计,题目难度中等,注意掌握原电池工作原理,能够根据反应原理画出正确的原电池装置图.


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
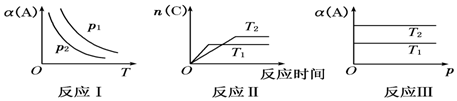
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:填空题
某金属加工厂排放的污水中含有CuSO4、ZnSO4、FeSO4,某研究小组利用该污水回收工业重要原料硫酸锌和有关金属,其流程如右图所示:请回答下列问题:
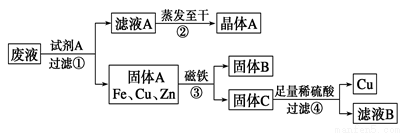
(1)下列说法正确的是________。
A.该工艺流程中发生了3个置换反应
B.CuSO4与MgCl2可以发生复分解反应
C.步骤①②③④都包含化学变化
D.滤液A和滤液B含有相同的溶质
(2)写出步骤①发生反应的离子方程式:_______________、________________。
(3)步骤④中加入足量稀硫酸的目的是________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
2015年5月郴州成功举办了第三届中国(湖南)国际矿物宝石博览会。矿博会上展示了色彩缤纷、形状各异的金属矿物,下列金属的冶炼属于热还原法的是( )
A.2NaCl(熔融)=2Na+Cl2↑
B.WO3+3H2 W+3H2O
W+3H2O
C.Fe+CuSO4=Cu+FeSO4
D.2Ag2O 4Ag+O2↑
4Ag+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com