
| A.4CuO(s)=2Cu2O(s)-+O2(g)在室温下不能自发进行,说明该反应△H<0 |
| B.生铁和纯铁同时放入海水中,纯铁更易腐蚀 |
| C.常温下,PbSO4易溶于pH=7的CH3COONH4溶液,说明((CH3COO)2Pb是弱电解质 |
D.H2S(g)+FeO(s)  FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大 FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大 |
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:不详 题型:问答题
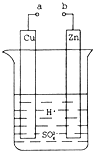
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| B.铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| C.其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积 |
| D.常温下,向饱和碳酸钠溶液中加入过量碳酸钡粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图①表示室温时,用0.1 mol.L-1盐酸滴定0.1 mol·L-1NaOH溶液过程中的pH变化 |
B.T℃时,反应2NO2(g) N2O4(g)达到平衡时NO2的体积分数 N2O4(g)达到平衡时NO2的体积分数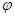 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 |
C.图③表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g) 2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 |
D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g) Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 将增大 将增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
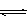 CH3OH(g)
CH3OH(g)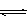 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)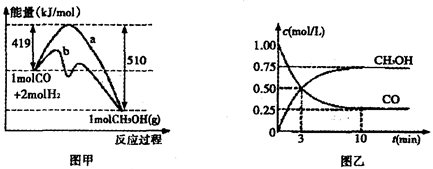
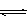 CH3OH(g)的化学平衡常数为__________.
CH3OH(g)的化学平衡常数为__________.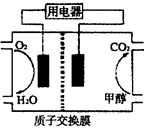
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| B.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量较高 |
C.A(g)+3B(g)  2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大 2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大 |
| D.在KI溶液中加入氯化银固体,沉淀变成黄色,说明同温度下Ksp(AgI)< Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离平衡常数Ka变小 |
| C.KSP(AgCl) > KSP(AgI) ,由此可以判断AgCl(s) + I-(aq)= AgI(s)+ Cl-(aq)能够发生 |
| D.Ka(HCN) < Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-) |
| B.浓度均为0.1mol·L-1的(NH4)2CO3溶液和(NH4)2SO4溶液中的c(NH4+) |
| C.3 L 0.1 mol·L-1CH3COOH溶液和1L 0.3 mol·L-1CH3COOH溶液中的H+离子数 |
| D.中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com