�ѣ�Ti������Ϊ��������֮��ĵ����������Ѱף�TiO
2����Ŀǰ��õİ�ɫ���ϣ��Ʊ�TiO
2��Ti��ԭ�����������ҹ�������������������λ������Fe
2O
3��������FeTiO
3����ȡTiO
2���������£�
��1��Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е�
��
��
���ڣ���
��B
��B
�壮
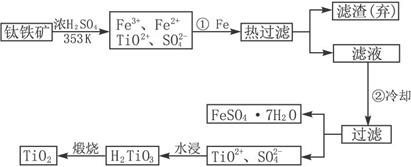
��2������ټ�Fe��Ŀ����
��Fe3+��ԭΪFe2+
��Fe3+��ԭΪFe2+
���������ȴ��Ŀ����
����������롢��õ���FeSO4?7H2O
����������롢��õ���FeSO4?7H2O
��
��3�������Ʊ�TiO
2�Ĺ����У��������õĸ�������
FeSO4?7H2O
FeSO4?7H2O
�����dzɱ��ͷ����ۺ��������أ���Һ��Ӧ����
ʯ�ң���̼��ơ��ϼ
ʯ�ң���̼��ơ��ϼ
������
��4���ɽ��ʯ��TiO
2����ȡ����Ti���漰���IJ���Ϊ����֪��
��C��s��+O
2��g��=CO
2��g������H=-393.5kJ?mol
-1
��2CO��g��+O
2��g��=2CO
2��g������H=-566kJ?mol
-1
��TiO
2��s��+2Cl
2��g��=TiCl
4��s��+O
2��g������H=+141kJ?mol
-1��TiO
2��s��+2Cl
2��g��+2C��s��=TiCl
4��s��+2CO��g���ġ�H=
-80kJ?mol-1
-80kJ?mol-1
����ӦTiCl
4+2Mg=2MgCl+Ti ��Ar������������
��ֹ������Mg��Ti��������е�O2����CO2��N2������
��ֹ������Mg��Ti��������е�O2����CO2��N2������
��




 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
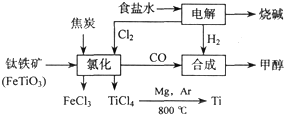
 2OH-+H2��+Cl2��
2OH-+H2��+Cl2�� 2OH-+H2��+Cl2��
2OH-+H2��+Cl2�� 2MgCl2��s��+Ti����Ar�����н��е������ǣ�
2MgCl2��s��+Ti����Ar�����н��е������ǣ�
