
| A. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-═2BaBO4↓+AlO2-+2H2O | |
| C. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO-3+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| D. | 向Fe(NO3)2溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
分析 A.二者反应生成碳酸钡、氢氧化钠和水;
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明成NH4Al(SO4)2与Ba(OH)2是1:2;
C.氢氧化钠过量,反应生成氢氧化镁沉淀、碳酸钠和水;
D.硝酸根离子在酸性环境下能够氧化三价铁离子.
解答 解:A.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故A正确;
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故B错误;
C.向Mg(HCO3)2溶液中加入过量的NaOH溶液,离子方程式:Mg2++2HCO-3+4OH-═Mg(OH)2↓+2CO32-+2H2O,故C正确;
D.向Fe(NO3)2溶液中加入稀硝酸,离子方程式:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,为高考的频考题,本题侧重考查氧化还原反应、复分解反应的离子方程式书写,明确物质的性质,氧化还原反应规律是解题关键,注意反应物用量对反应的影响,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应①中硝酸铵既是氧化剂又是还原剂,H2O是氧化产物 | |
| B. | 反应②中K2SO3是还原剂,N2O是氧化产物 | |
| C. | 反应③中每生成1 mol N2O,转移8 mol电子 | |
| D. | 反应④中NaNO3是还原剂,N2O既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、O2、CO、NH3 | B. | H2、O2、SO2、NH3 | C. | H2、Cl2、HCl、NH3 | D. | NO、O2、NO2、NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5×10-4m mol | B. | 5.0×10-4m mol | C. | 7.5×10-4m mol | D. | 1×10-3m mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将二氧化碳通过过氧化钠使其增重ag 反应中转移电子数为 $\frac{a{N}_{A}}{14}$ | |
| B. | 1mol Cl2 通入水中,则n(HClO)+n(Cl-)+n(ClO-)=2NA | |
| C. | 常温常压下,3克含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| D. | 2.24升的甲烷中含有的C-H键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
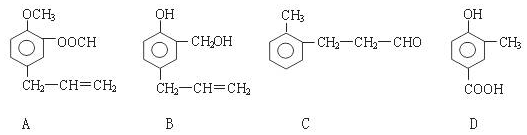
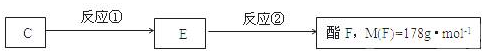
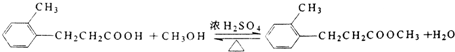 ;.
;.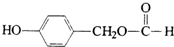 ;H:
;H: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | OH-的物质的量 | ||
| C. | c(H+)×c(OH-) | D. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com