
| A. | CO2通入CaCl2溶液中 | B. | NO2通入FeSO4溶液中 | ||
| C. | NH3通入A1C13溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
分析 A.二氧化碳通入氯化钙溶液中不能发生反应;
B.二氧化氮具有氧化性,能氧化亚铁离子为铁离子;
C.氨气通入水溶液中生成一水合氨,一水合氨和铝离子结合生成氢氧化铝沉淀;
D.二氧化硫通入硝酸钡溶液中,二氧化硫和水反应生成酸,溶液中存在稀硝酸能氧化二氧化硫生成硫酸,硫酸和钡离子生成白色沉淀硫酸钡;
解答 解:A.碳酸酸性小于盐酸,二氧化碳通入氯化钙溶液中不发生反应,无明显现象,故A正确;
B.NO2通入FeSO4溶液中,二氧化氮和水反应生成硝酸和一氧化氮,硝酸具有强氧化性能氧化硫酸亚铁为硫酸铁,溶液颜色浅绿色变化为黄色,故B错误;
C.NH3通入A1C13溶液中发生反应生成氢氧化铝白色沉淀,Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.SO2通入Ba(NO3)2溶液中,发生氧化还原反应生成白色的硫酸钡沉淀,故D错误;
故选A.
点评 本题考查了物质性质、反应现象、溶液中隐含离子的性质分析判断、掌握基础是解题关键,题目难度中等.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:选择题
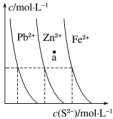 如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )
如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )| A. | 三种难溶物的溶度积Ksp(FeS)的最小 | |
| B. | 如果向三种沉淀中加盐酸,最先溶解的是PbS | |
| C. | 向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS沉淀 | |
| D. | 对于三种难溶物来讲,a点对应的都是不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性强弱顺序为XO42->Z2>R2>M3+ | |
| B. | Z2在③中发生氧化反应 | |
| C. | R元素在反应②中被氧化,在③中被还原 | |
| D. | 常温下反应不可进行2M2++Z2═2M3++2Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
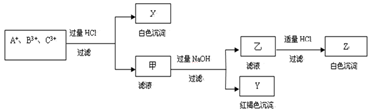
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
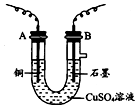 某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 浓度(mol•L-1) 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应属于分解反应 | B. | 图中的两种化合物都属于氧化物 | ||
| C. | 该反应中元素的化合价没有变化 | D. | 反应前后原子的种类改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com