
【题目】研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构被称作“纳米泡沫”,纳米泡沫碳与金刚石的关系是( )
A. 同素异形体 B. 同位素 C. 同系物 D. 同分异构体
科目:高中化学 来源: 题型:
【题目】“漆器”是中国古代在化学工艺及工艺美术方面的重要发明,所用生漆是从我国特产漆树割取的天然液汁。生漆主要成分是漆酚![]() ,—C15H27为链烃基,则漆酚不应具有的化学性质是
,—C15H27为链烃基,则漆酚不应具有的化学性质是
A. 可以跟FeCl3溶液发生显色反应 B. 可以使酸性KMnO4溶液褪色
C. 可以跟Na2CO3溶液反应放出CO2 D. 可以发生取代反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存,并且溶液为无色透明的是( )
A.K+、Ca2+、HCO3-、Cl- B.Cu2+、Na+、NO3-、Cl-
C.Na+、K+、Mg2+、SO42- D.Mg2+、Fe3+、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碱性蓄电池在充电和放电时发生的反应为:
Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列说法中正确的是
Fe(OH)2+Ni(OH)2,下列说法中正确的是
A. 放电时,负极上发生反应的物质是Fe
B. 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2
C. 充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O
D. 充电时,阳极附近pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.甲醇作为一种较好的可再生能源,具有广泛的应用前景。
已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) ![]() CH3OH(g) H1=-90kJ·mol-1
CH3OH(g) H1=-90kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g) + H2(g) H2=-41kJ·mol-1
CO2(g) + H2(g) H2=-41kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:___________________。
Ⅱ. 已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度 | ||
500℃ | 700℃ | 800℃ | ||
2H2(g) + CO(g) | K1 | 2.5 | 0.34 | 0.15 |
H2(g) + CO2(g) | K2 | 1 | 1.7 | 2.52 |
3H2(g)+CO2(g) | K3 | |||
请回答下列问题:
(1)反应①是__________(填“吸热”或“放热“)反应
(2)观察①②③可推导出K1、K2、K3之间的关系,则K3=_______(用K1、K2表示)
(3)某温度时,反应①式中各物质的平衡浓度符合下式:20×c(CH2OH)=3×c(CO)×c3(H2),试判断此时的温度为____________。
(4)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.4 mol· L-1、1 mol·L-1、0.5 mol·L-1、0.4 mol·L-1molL-1,则此时V(正)______V(逆)(填“>”、 “=”或“<”)。
(5)对应反应③,一定条件下将H2(g)和CO2(g)以体积比3:1置于恒温恒容的密闭容器发生反应,下列能说明该反应达平衡状态的有_____________。
A.体系密度保持不变
B.H2和CO2的体积比保持不变
C.混合气体的平均相对分子量不变时,反应一定达到平衡状态
D.当破坏CO2中2个碳氧双键,同时破坏H2O中的2个氧氢键,反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产和生活中广泛存在。请回答下列有关问题:
(1)氯胺(NH2Cl)是一种长效缓释消毒剂,可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)
△H=+12kJ·mol-1来制取。
![]()
己知部分化学键的键能如上表所示(假定不同物质中同种化学键的键能一样),则a=______。
(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g)![]() N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0
N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0
(b)N2O2(g)+ O2(g)=2N02(g) (慢) Vb正=Kb正c2(N2O2)·c2(O2),Vb逆=Kb逆c2(NO2),△H2<0
①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,其平衡常数K=______(用ka正、Ka逆、Kb正、Kb逆表示)。
2NO2(g)达到平衡状态,其平衡常数K=______(用ka正、Ka逆、Kb正、Kb逆表示)。
②100KPa时,密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g), NO的平衡转化率与温度的关系曲线如右图所示:图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则__点对应的压强最大,原因是______________。
2NO2(g), NO的平衡转化率与温度的关系曲线如右图所示:图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则__点对应的压强最大,原因是______________。
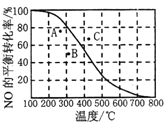
③反应2NO(g)+O2(g)![]() 2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g)
2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g)![]() 2NO(g) △H=+180kJ/mo1,则此反应对NO的转化率的影响是____(填“增大”、“减小”或“无法判断”)。
2NO(g) △H=+180kJ/mo1,则此反应对NO的转化率的影响是____(填“增大”、“减小”或“无法判断”)。
④某温度下,反应2NO(g)+O2(g)![]() 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积.平衡将_____(填“正反应方向”、“逆反应方向”或“不”)称动。判断的依据是_____。 (3)工业上可通过电解NO制备NH4NO3,其工作原理如右图所示。①该装置的阳极是_____(填“电极a”、“电极b”)。
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积.平衡将_____(填“正反应方向”、“逆反应方向”或“不”)称动。判断的依据是_____。 (3)工业上可通过电解NO制备NH4NO3,其工作原理如右图所示。①该装置的阳极是_____(填“电极a”、“电极b”)。
②电解过程总反应的化学方程式为___________。
③若维持电流强度为6A,电解5小时,理论上可制祠NH4NO3的最大质量为_____g。(已知F=96500C/mol,保留小数点后l位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com