
【题目】将一定质量的镁、铝合金投入100mL一定物质的量浓度盐酸中,合金全部溶解,向所得溶液中滴加4mol /LNaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如图(横坐标体积单位是mL,纵坐标质量单位是g),求:
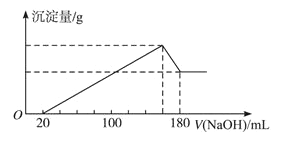
(1)原合金中Mg、Al质量各多少克?_________
(2)盐酸的物质的量浓度c(HCl)=____________
【答案】 m(Mg)=3.84g m(Al)=2.16g 6.4mol/L
【解析】(1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O。继续滴加NaOH溶液,到沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液。再继续滴加NaOH溶液,沉淀量开始减少,到沉淀量最小时,沉淀为Mg(OH)2,溶解氢氧化铝消耗氢氧化钠溶液的体积是180mL-160mL=20mL=0.02L,氢氧化钠的物质的量是0.08mol,根据方程式Al(OH)3+NaOH=NaAlO2+2H2O可知氢氧化铝的物质的量是0.08mol。由元素守恒可知,n(Al)=n[Al(OH)3]=0.08mol,所以m(Al)=0.08mol×27g/mol=2.16g;生成氢氧化铝需要氢氧化钠溶液的体积是溶解氢氧化铝需要氢氧化钠溶液体积的3倍,即生成0.08mol氢氧化铝消耗60mL氢氧化钠。所以与镁离子反应生成氢氧化镁消耗氢氧化钠溶液的体积是160mL-20mL-60mL=80mL,物质的量的物质的量是0.32mol,则镁离子的物质的量是0.16mol,所以m(Mg)=0.16mol×24g/mol=3.84g;(2)加入20mLNaOH溶液,恰好中和剩余的盐酸,此时溶液中溶质为AlCl3、MgCl2、NaCl,根据氯元素守恒有n(HCl)=3n(AlCl3)+2n(MgCl2)+n(NaCl),根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.02L×4mol/L=0.08mol,所以n(HCl)=3n(AlCl3)+2n(MgCl2)+n(NaCl)=3×0.08mol+2×0.16mol+0.08mol=0.64mol,因此原盐酸的物质的量浓度为0.64mol÷0.1L=6.4mol/L。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作还原剂的是( )
A. NaOH + HCl = NaCl + H2O
B. Zn + 2HCl = ZnCl2 + H2↑
C. MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
D. CuO + 2HCl = CuCl2 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,把一个盛有一定量的甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体发生反应,下列叙述中不正确的是
A. 容器内原子的总数不变B. 容器内的分子总数不变
C. 容器内压强不变D. 发生的反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )
A. 2F2+2H2O == 4HF+O2↑ B. C+H2O![]() CO+H2
CO+H2
C. 2Na+2H2O == 2NaOH+H2↑ D. Cl2+H2O == HCl+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和NaCl溶液是化学工业的重要反应之一。20℃时,饱和NaCl溶液的密度为ρg·cm-3,物质的量浓度为cmol·L-1,则下列说法中不正确的是( )
A. 温度高于20℃时,饱和NaCl溶液的密度大于ρg·cm-3
B. 此溶液中NaCl的质量分数为58.5c/(1000ρ)%
C. 20℃时,浓度小于c mol·L-1的NaCl溶液是不饱和溶液
D. 20℃时,饱和NaCl溶液的溶解度S=5850c/(1000ρ-58.5c)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应放热反应A+B=C,下列条件的改变一定能使化学反应速率加快的是 ( )
A. 增加A的物质的量B. 升高体系温度C. 增加体系压强D. 降低体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1;
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJmol﹣1 .
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1:1
B.1:3
C.1:4
D.2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com