
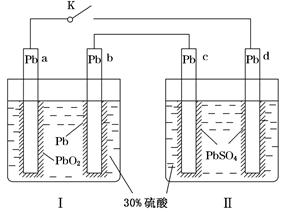
| A.闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42— |
| B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol |
| C.闭合K时,Ⅱ中SO42—向c电极迁移 |
| D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源:不详 题型:单选题
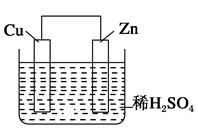
| A.锌为正极,空气进入负极反应 | B.负极反应为Zn-2e-=Zn2+ |
| C.正极发生氧化反应 | D.电解液为强酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.③④⑤ | C.④⑤⑥ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.铁棒的腐蚀程度:甲<乙 |
| B.碳电极上发生反应的电极反应式相同 |
| C.溶液的pH:甲减小,乙增大 |
| D.甲乙产生气体的体积(相同条件)比为3:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 。下列叙述正确的是( )
。下列叙述正确的是( )A.放电时C 向正极移动 向正极移动 |
| B.放电时OH-向负极移动 |
C.负极反应为H2+C -2e-=H2O+CO2 -2e-=H2O+CO2 |
| D.当该电池产生的水蒸气折算成标准状况下的体积为22.4 L时,转移电子4 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.A的金属性强于B |
| B.A电极上发生的电极反应是还原反应 |
| C.电子不断由A电极经外电路流向B电极 |
| D.A在金属活动性顺序表中一定排在氢前面 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电池总反应为Mg+H2O2 = Mg(OH)2 |
| B.正极发生的电极反应为H2O2+2H++2e- = 2H2O |
| C.工作时,正极周围海水的pH减小 |
| D.电池工作时,溶液中的H+向负极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com