


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 欲用含有少量氯化钙的氯化钠固体,配制100mL 1mol/L的氯化钠溶液,设计了下面的操作方案.根据方案操作步骤回答下列问题:
欲用含有少量氯化钙的氯化钠固体,配制100mL 1mol/L的氯化钠溶液,设计了下面的操作方案.根据方案操作步骤回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
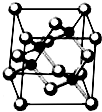 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)
Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是__________(填序号)
A.砷化镓晶胞结构与NaCl相同 B.第一电离能 As>Ga
C.电负性 As>Ga D.原子半径 As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为__________;
(3)AsH3空间形状为___________;已知(CH3)3 Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因 , Cu2+的核外电子排布式为__________________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有 和 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年吉林省长春市高三第二次模拟考试(理综)化学部分 题型:填空题
(15分)
Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:

(1)下列说法正确的是__________(填序号)
A.砷化镓晶胞结构与NaCl相同 B.第一电离能 As>Ga
C.电负性 As>Ga D.原子半径 As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为__________;
(3)AsH3空间形状为___________;已知(CH3)3 Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因 , Cu2+的核外电子排布式为__________________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有 和 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com