
| A | B | C | D | |
| A | - | - | ↑ | |
| B | - | ↓ | ↓ | |
| C | - | ↓ | - | |
| D | ↑ | ↓ | - |
分析 A、B、C、D四瓶溶液,分别是Na2SO4、Na2SO3、HCl、BaCl2,A与其它物质反应只有一个有气体产生,其它都没有现象,所以A为HCl,D为Na2SO3,产生的气体为二氧化硫,B与其它物质反应有两个沉淀的现象,所以B为BaCl2,分别产生硫酸钡沉淀和亚硫酸钡沉淀,C与其它物质反应只有一个有沉淀现象,所以C为Na2SO4,亚硫酸钠与盐酸有气体,与氯化钡有沉淀,符合题中各物质间反应的现象,据此答题;
解答 解:A、B、C、D四瓶溶液,分别是Na2SO4、Na2SO3、HCl、BaCl2,A与其它物质反应只有一个有气体产生,其它都没有现象,所以A为HCl,D为Na2SO3,产生的气体为二氧化硫,B与其它物质反应有两个沉淀的现象,所以B为BaCl2,分别产生硫酸钡沉淀和亚硫酸钡沉淀,C与其它物质反应只有一个有沉淀现象,所以C为Na2SO4,亚硫酸钠与盐酸有气体,与氯化钡有沉淀,符合题中各物质间反应的现象,综上所述,A为HCl,B为BaCl2,C为Na2SO4,D为Na2SO3,
故答案为:HCl;BaCl2;Na2SO4;Na2SO3.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、物质之间的反应及现象为解答的关键,侧重分析与推断能力的考查,注意A、B物质为推断的突破口,题目难度不大.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 结构示意图 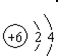 :表示碳原子 :表示碳原子 | |
| B. | 比例模型 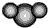 :表示二氧化碳分子 :表示二氧化碳分子 | |
| C. | 电子式 :表示羟基 :表示羟基 | |
| D. | H++OH-═H2O:表示醋酸和氢氧化钠的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度可以增大活化分子百分数,从而使反应速率增大 | |
| B. | 汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能 | |
| C. | 在“反应热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度 | |
| D. | 研制性能优良的催化剂既可以提高化学反应速率,又能起到很好的节能效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、HCO3-、Br- | B. | SO32-、Al(OH)4-、K+、Al3+ | ||
| C. | Fe3+、Na+、NO3-、CO32- | D. | NH4+、Na+、SiO32-、I- | ||
| E. | Ca2+、Na+、NO3-、PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1 | |
| B. | 18gH2O在标准状况下的体积是22.4L | |
| C. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| D. | 在标准状况时,20mLNH3与60mLNO所含的原子个数比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除④外都对 | B. | 除⑤外都对 | C. | ④⑤不对 | D. | 全都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
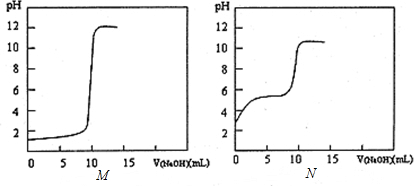
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com